
分析 (1)氧化性Cl2>Br2>Fe3+>I2,还原性I->Fe2+>Br->Cl-,所以氯气先氧化亚铁离子后氧化溴离子,
发生的离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-、2Br-+Cl2=2Cl-+Br2,根据原子守恒知,1molFeBr2中n(Fe2+)=n(FeBr2)=1mol,n(Br- )=2n(FeBr2)=2mol,根据方程式知,1molFe2+完全被氧化需要0.5mol氯气,0.5mol氯气能氧化1mol溴离子;
(2)氧化性Cl2>Br2>Fe3+>I2,还原性I->Fe2+>Br->Cl-,所以氯气先氧化碘离子后氧化亚铁离子,发生的离子反应方程式为2I-+Cl2=2Cl-+I2、2Fe2++Cl2=2Fe3++2Cl-,根据原子守恒知,1molFeBr2中n(Fe2+)=n(FeI2)=1mol,n(I- )=2n(FeI2)=2mol,根据方程式知,2mol碘离子完全被氧化需要1mol氯气,则没有氯气氧化亚铁离子.
解答 解:(1)氧化性Cl2>Br2>Fe3+>I2,还原性I->Fe2+>Br->Cl-,所以氯气先氧化亚铁离子后氧化溴离子,
发生的离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-、2Br-+Cl2=2Cl-+Br2,根据原子守恒知,1molFeBr2中n(Fe2+)=n(FeBr2)=1mol,n(Br- )=2n(FeBr2)=2mol,根据方程式知,1molFe2+完全被氧化需要0.5mol氯气,根据Fe原子守恒知同时生成n(Fe3+)=1mol,0.5mol氯气能氧化1mol溴离子,剩余n(Br- )=2mol-1mol=1mol,氯气完全转化为氯离子,根据Cl原子守恒知,n(Cl-)=2n(Cl2)=2mol,
故答案为:1mol;1mol;2mol;
(2)氧化性Cl2>Br2>Fe3+>I2,还原性I->Fe2+>Br->Cl-,所以氯气先氧化碘离子后氧化亚铁离子,发生的离子反应方程式为2I-+Cl2=2Cl-+I2、2Fe2++Cl2=2Fe3++2Cl-,根据原子守恒知,1molFeBr2中n(Fe2+)=n(FeI2)=1mol,n(I- )=2n(FeI2)=2mol,根据方程式知,2mol碘离子完全被氧化需要1mol氯气,则没有氯气氧化亚铁离子,所以n(Fe3+)=0、n(I- )=0,据Cl原子守恒知,n(Cl-)=2n(Cl2)=2mol,
故答案为:0;0;2mol.
点评 本题考查氧化还原反应的有关计算,为高频考点,明确离子反应先后顺序是解本题关键,根据方程式中各个物理量之间的关系结合原子守恒解答即可,注意离子反应先后顺序,为易错题.


科目:高中化学 来源: 题型:选择题

| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成它的小分子结构简式为CH2=CHCOOR(R为烃基) | |
| B. | 在一定条件下能发生加成反应 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 没有固定的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:X | D和E 1:3 | B和E 1:4 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
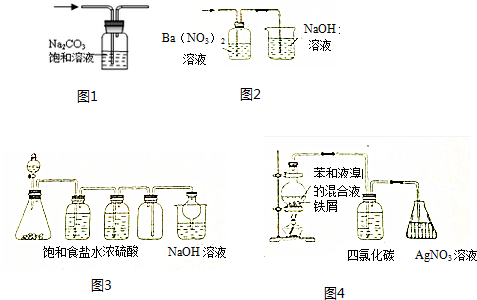
| A. | 用图1装置出去CO2中混有的HCl气体 | |
| B. | 用图2装置除去SO2中混有的SO3气体 | |
| C. | 用图3装置可以制备并收集Cl2 | |
| D. | 用图4装置证明苯与液溴能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com