
| A. | 滴入酚酞溶液变红,再加入H2SO4溶液红色退去 | |
| B. | 滴入酚酞溶液变红,再加入氯水后红色退去 | |
| C. | 滴入酚酞溶液变红,在加入BaCl2溶液后产生沉淀且红色退去 |
分析 如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡,据此进行解答.
解答 A.滴入酚酞试液变红,说明溶液呈碱性,再加入硫酸溶液后,硫酸与亚硫酸钠反应,且硫酸溶液呈酸性,可以时溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故A错误;
B.滴入酚酞试液变红,再加入氯水后,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使红色褪色,氯气具有强氧化性,Cl2+SO32-+H2O═SO42-+2Cl-+2H+,Cl2+HSO3-+H2O═SO4 2-+2Cl-+3H+,溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故B错误;
C.滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和亚硫酸氢根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,所以说明存在SO32-+H2O?HSO3-+OH-水解平衡,故C正确,
故选C;
点评 本题考查盐的水解原理及其应用,题目难度不大,明确盐的水解原理及其影响为解答关键,试题侧重基础知识的考查,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数等于或大于3(小于8)的元素一定是主族元素 | |
| B. | 元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱 | |
| C. | 在主族元素中,最高正化合价均等于主族序数 | |
| D. | 元素的原子得电子越多,非金属性越强;失电子越多,金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
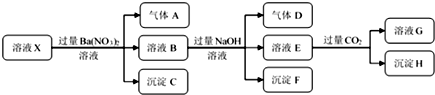
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3,工业上往BaCO3中加入饱和的Na2CO3可以实现BaSO4的转变 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中,零族元素的单质在常温下全部都是气体 | |
| B. | 同周期元素,ⅦA族的原子半径最大 | |
| C. | ⅥA族元素的原子,其半径越大,越容易失去电子 | |
| D. | 所有主族元素的原子形成单原子离子时的最高化合价数都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加NaOH,后加Na2CO3,再加BaCl2 | B. | 先加NaOH,后加BaCl2,再加Na2CO3 | ||
| C. | 先加Na2CO3,后加NaOH,再加BaCl2 | D. | 先加Na2CO3,后加BaCl2,再加NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 3:3:1 | C. | 1:2:3 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硼的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt见光容易分解,但不溶于水也不溶于稀酸 | |
| C. | 氢氧化铷(RbOH)易溶于水 | |
| D. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com