
分析 硫化氢燃烧生成二氧化硫的化学方程式:2H2S+3O2=2SO2+2H2O,2H2S+SO2=3S↓+2H2O,根据硫化氢和氧气的量进行回答.
解答 解:硫化氢燃烧生成二氧化硫的化学方程式:2H2S+3O2=2SO2+2H2O,8体积的氧气充分燃烧生成$\frac{16}{3}$体积的二氧化硫,消耗$\frac{16}{3}$体积的H2S,余下的硫化氢会生成二氧化硫反应,剩余硫化氢$\frac{14}{3}$体积,所以会发生反应:2H2S+SO2=3S↓+2H2O,硫化氢$\frac{14}{3}$体积会消耗掉$\frac{7}{3}$体积的二氧化硫,所以最终会生成二氧化硫的体积是$\frac{16}{3}-\frac{7}{3}$=3体积,答:生成二氧化硫的体积为3.
点评 本题考查学生含硫化合物的性质知识,注意知识的归纳和梳理是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
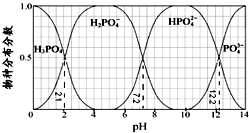
| A. | H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 | |
| B. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| C. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 | |
| D. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b | c | d | |
| A | Cu | CuSO4 | Cu(OH)2 | Cu2O |
| B | N2 | NO2 | HNO3 | NO |
| C | CH3OH | HCHO | HCOOH | HCOOCH3 |
| D | Na | Na2O2 | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下28g氮气含有的原子数是2NA | |
| B. | 标准状况下,22.4L醋酸的水分子数是NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 500mL 2mol•L-1Al(SO4)3溶液中SO42-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol/L | |
| B. | HCl溶液滴加一半时,溶液pH>7 | |
| C. | 0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
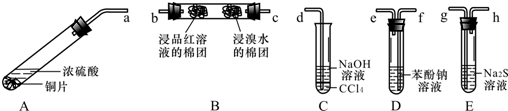
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使石蕊试液褪色 | B. | 与足量的NaOH溶液反应生成Na2SO4 | ||
| C. | 不能与过氧化氢(H2O2)溶液反应 | D. | 能使品红褪色,加热后又出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铜丝搅拌棒测定出来的中和热值偏大 | |
| B. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol | |
| C. | 将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=-(2×57.3)KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com