
分析 钠的物质的量为1mol,由2Na+2HCl=2NaCl+H2↑,可知HCl不足,故Na还与水发生反应:2Na+2H2O=2NaOH+H2↑,由方程式可知2Na~H2↑,据此计算生成氢气的体积.
解答 解:钠的物质的量为$\frac{23g}{23g/mol}$=1mol,由2Na+2HCl=2NaCl+H2↑,可知HCl不足,故Na还与水发生反应:2Na+2H2O=2NaOH+H2↑,
设生成氢气体积为V,则:
2 Na~H2↑,
2mol 22.4L
1mol V
V=$\frac{22.4L×1mol}{2mol}$=11.2L
答:标况下生成氢气为11.2L.
点评 本题考查化学方程式有关计算,明确发生的反应即可解答,注意酸不足时Na与水反应也生成氢气.


科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式: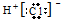 | B. | 氯离子的结构示意图: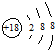 | ||
| C. | 甲烷分子的比例模型: | D. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.265mol•L-1 | B. | 0.525mol•L-1 | C. | 0.21mol•L-1 | D. | 0.42mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
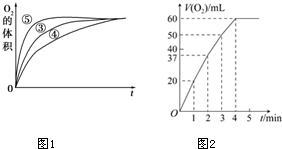 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分组实验 | 催化剂 | |
| ① | 10mL 5% H2O2溶液 | 无 |
| ② | 10mL 2% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com