
 ,下列说法正确的是( )
,下列说法正确的是( )| A、HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 |
| B、1mol苹果酸可与3mol NaOH发生中和反应 |
| C、1mol苹果酸与足量金属Na反应生成生成1mol H2 |
| D、苹果酸在一定条件下能发生缩聚反应 |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
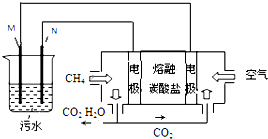 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图:a、b、c、d均为铂电极,供选择的四组电解液如下:
如图:a、b、c、d均为铂电极,供选择的四组电解液如下:| 组 | A | B | C | D |
| 甲槽 | NaOH | AgNO3 | H2SO4 | NaCl |
| 乙槽 | CuSO4 | CuCl2 | AgNO3 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示:
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏烧瓶必须垫石棉网加热 |
| B、蒸馏烧瓶中应加入碎瓷片,防止出现暴沸现象 |
| C、蒸馏是利用物质溶解性的差异将物质加以分离的操作 |
| D、冷凝管中的水流是从下口进入,上口排出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和此溶液所需的0.1 mol?L-1 NaOH溶液的体积增加 |
| B、c(CH3COOH)减小,平衡向电离方向移动,c(CH3COO-)增大 |
| C、平衡向电离方向移动,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均减小 |
| D、电离程度增大,由CH3COOH电离出的n(H+)变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com