
【题目】某元素原子3p能级上有一个空轨道,则该元素为
A. Na B. Mg C. Al D. Si
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
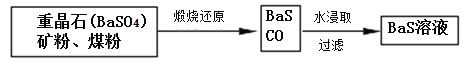
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
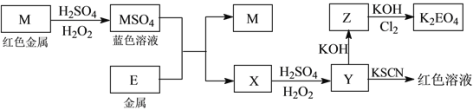
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:_______________________________。
(2)检验X中阳离子的方法和现象是__________________________________________________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:_______________________________、____________________________________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 __________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
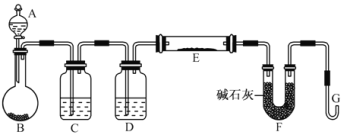
①仪器B中应装入___________,装置D的作用_________________________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
___________________________在这两步之间还应进行的操作是_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。通过查阅资料,学习小组获知:FeCl3是一种共价化合物,熔点306℃,沸点315℃。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)现象i中的白雾是___________________,形成白雾的原因是________________。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。
通过该实验说明现象ii中黄色气体含有_______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
原因①:实验b检出的气体使之变蓝,反应的离子方程式是______________________________。
原因②:在酸性条件下,装置中的空气使之变蓝,反应的离子方程式是_______________。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试荆是____________________。
②方案2中检验Fe2+的试剂是____________________。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是_____________________。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,物质的量最大的是__________,含分子个数最多的是________,含原子个数最多的是_________,质量最大的是__________(填字母)。
A.6g氢气 B.0.5molCO2 C.1.204×1023个CO分子 D.147g H2SO4 E.92g乙醇(C2H5OH)
(2)NA表示阿伏加德罗常数的值
①1.204×1023个水分子中共________mol氢原子。
②某气体在同温同压下对H2相对密度为32,则该气体的相对分子质量为__________。
③某气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是___g/mol。
④25g CuSO4·5H2O晶体中含有氧原子______个。
⑤16gO2含有的氧分子数与______g CO2含有的氧原子数相等。
⑥标准状况下,11.2 L CH4中含有的氢原子数为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A. 金刚石和石墨互为同位素
B. C2H6和C5H12互为同系物
C. C2H4和C2H6互为同系物
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com