
【题目】硼及其化合物在工农业生产中具有广泛应用。
请回答下列问题:
(1)基态B原子的价电子排布图___,B属于元素周期表中的___区元素。
(2)NaBO2可用于织物漂白。
①第二周期中第一电离能介于B和O之间的元素为___(填元素符号)。
②BO2-的空间构型为____,写出两种与其互为等电子体的分子的化学式:____。
(3)BF3和F-可以形成BF4-,BF3和BF4-中B原子的杂化方式分别为_____、____。
(4)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为______。
(5)一种新型轻质储氢材料的晶胞结构如图所示:
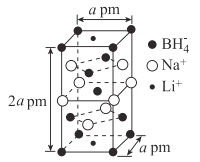
①该化合物的化学式为____。
②设阿伏加德罗常数的值为NA,该晶体的密度为___g·cm-3(用含a、NA的代数式表示)。
【答案】![]() p Be、C 直线形 CO2或CS2或N2O或BeCl2 sp2 sp3 B原子半径更小,B—N键键长更短,键能更大 Na3Li(BH4)4
p Be、C 直线形 CO2或CS2或N2O或BeCl2 sp2 sp3 B原子半径更小,B—N键键长更短,键能更大 Na3Li(BH4)4 ![]()
【解析】
(1)硼为5号元素,属于p区元素,其基态原子的价电子排布图为![]() 。故答案为:
。故答案为:![]() ,p。
,p。
(2)①Be的2s能级处于全满,第一电离能:Be>B,N的2p能级处于半满,第一电离能:N>O,故第一电离能介于B和O之间的元素只有Be、C两种。
②![]() 的中心原子的价层电子对数为2,孤电子对数为0,立体构型为直线形;与
的中心原子的价层电子对数为2,孤电子对数为0,立体构型为直线形;与![]() 互为等电子体的分子有CO2、CS2、N2O、BeCl2等。故答案为:直线形,CO2或CS2或N2O或BeCl2。
互为等电子体的分子有CO2、CS2、N2O、BeCl2等。故答案为:直线形,CO2或CS2或N2O或BeCl2。
(3)BF3和![]() 中B原子的价层电子对数分别为2、3,所以其杂化方式分别为sp2、sp3。
中B原子的价层电子对数分别为2、3,所以其杂化方式分别为sp2、sp3。
(4)立方BN和立方AlN均为原子晶体,B原子半径更小,B—N键键长更短,键能更大,熔点更高。
(5)①根据均摊法可得,该物质的化学式为Na3Li(BH4)4。
②![]() ,该晶体的密度
,该晶体的密度![]() 。
。


科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
 ,下列说法正确的是( )
,下列说法正确的是( )
A. NaOH溶液可以用氨水来代替
B. 溶液a中含有Al3+、K+、Cl-、Na+、OH-
C. 溶液b中只含有NaCl
D. 向溶液a中滴加盐酸需控制溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黑色物质甲只含两种元素,为探究物质甲的组成和性质,设计并完成如下实验。其中气态氢化物乙在标况下的密度为 1.518 g·L-1,甲和乙中相同元素的化合价相同。
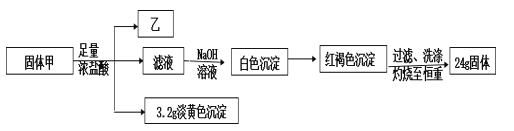
(1)甲的组成元素_____________。
(2)写出甲与足量浓盐酸反应的离子方程式______________。
(3)气体乙在过量空气中充分燃烧后,再将混合气体通入BaCl2溶液,出现白色沉淀。写出该过程中总反应的离子方程式_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图1装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
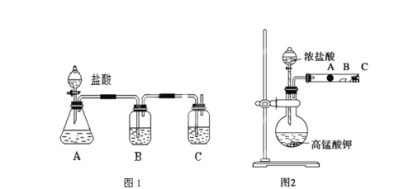
(1)根据实验图1作答:
①写出选用试剂分别 B__________,C____________
②装置B中所盛试剂的作用为_________
③C中反应的离子方程式为_______
④从实验所得非金属性C____Si(填“大于”或“小于”)
(2)根据实验图2作答:
①写出 A处的离子方程式:_______
②B处的现象_____
③C处药品的作用 _______。
④通过图2 装置实验得出同主族元素性质的递变规律为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下,
NH3H2O | Kb=1.8×10-5 |
H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
HF | Ka=6.8×10-4 |
H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
H2O | Kw=10-14 |
Cu(OH)2 | Ksp=2.2×10-20 |
Fe(OH)3 | Ksp=4.0×10-38 |
CuS | Ksp=6.3×10-36 |
FeS | Ksp=3.6×10-18 |
常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F 溶液显____性,保存此溶液应该放在__________中。
(2)NH4HCO3 溶液与少量 NaOH 溶液反应时,_____ (填离子符号)先与 NaOH 溶液中的 OH-反应。
(3)向含Fe3+和Cu2+均为0.1mol/L的溶液中加入某碱调节pH=___时,Fe3+完全沉淀,当pH=_____时,Cu2+开始沉淀,
(4)反应 CuS(s) + H2SO4(aq)![]() H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq)
H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq) ![]() H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)
H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的 K=_______
FeS(s)+Cu2+(aq)的 K=_______
由计算结果可以知道:实验室制备H2S气体应选用_________,检验H2S气体应选用_________(均用上述反应中的盐类物质作答)
除去废水中的 Cu2+使用 过量的 FeS 固体的优点有:
a.可以除去废水中的 Cu2+,过量的 FeS 和生成的 CuS 可以通过过滤一并除去
b.____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于氢氧燃料电池,下列说法正确的是( )
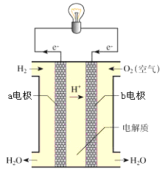
A.用 KOH 做电解质,负极反应是 H2-2e-+2OH-=2H2O
B.电子从 a 电极通过外电路到 b 电极最终移到 a 电极形成闭合回路
C.原电池不能将化学能百分之百转化成电能
D.氢氧燃料电池在使用过程中会看到淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子或化学方程式正确的是
A. Na2S俗名臭碱的原因: S2-+2H2O ![]() H2S+2OH-
H2S+2OH-
B. AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
C. CuSO4溶液和Na2S溶液混合:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
D. Na2SO3(aq)蒸干得不到Na2SO3(s)的原因: 2Na2SO3+O2 === 2Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com