
分析 (1)甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,在得失电子相等的条件下,将电极反应式相加即得电池反应式;
(2)该燃料电池中,负极上CO失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子,在得失电子相同条件下将正负极电极反应式相加即可得电池反应式,据此分析解答;
(3)铅蓄电池放电时,Pb在负极失电子发生氧化反应,PbO2在正极得到电子发生还原反应生成硫酸铅;放电过程中硫酸参加反应,所以随着反应的进行,氢离子浓度减小.
解答 解:(1)甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上电极反应式为CH4+10OH--8e-=CO32-+7H2O,正极上电极反应式为为O2+2H2O+4e-=4OH-,在得失电子相等的条件下,将电极反应式相加即得电池反应式,所以电池反应离子方程式为:CH4+2OH-+2O2=CO32-+3H2O,
故答案为:负极;CH4+10OH--8e-=CO32-+7H2O;CH4+2OH-+2O2=CO32-+3H2O;
(2)该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2 CO32-,负极上燃料CO失电子和碳酸根离子反应生成二氧化碳,电极反应式为2CO+2 CO32--4e-═4CO2,在得失电子相同条件下将正负极电极反应式相加得电池反应式2CO+O2═2CO2,
故答案为:O2+2CO2+4e-═2CO32-;2CO+O2═2CO2;
(3)铅蓄电池的电池总反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,Pb在负极失电子发生氧化反应,其电极反应为:Pb+SO42--2e-=PbSO4,放电过程中硫酸参加反应,所以随着反应的进行,氢离子浓度减小,所以溶液的pH变大,故答案为:Pb+SO42--2e-=PbSO4;变大.
点评 本题综合考查了原电池的内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:多选题
| A. | 第一电离能:Y一定小于X | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的 | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
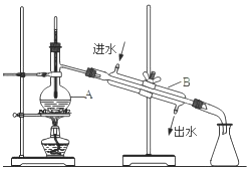 如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当光束通过下列分散系:有尘埃的空气、豆浆、墨水都能观察到丁达尔效应 | |
| B. | 溶液、胶体、浊液的根本区别是分散质微粒直径的大小 | |
| C. | 把1mL0.1mol/L三氯化铁溶液滴加入20mL沸水中,边加边振荡,可制得氢氧化铁胶体 | |
| D. | 胶体的稳定性介于溶液和浊液之间,属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
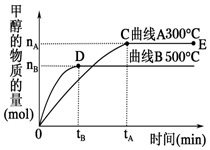 一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )
一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡常数K(300℃)<K(500℃) | |
| B. | 500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{nB}{3tB}$ mol•L-1•min-1 | |
| C. | 在其他条件不变的情况下,将处于E点的体系的容积压缩到原来的$\frac{1}{2}$,氢气的浓度减小 | |
| D. | 300℃,当容器内压强不变时说明反应已经达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
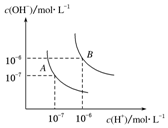 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| B. | CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液也不反应 | |
| C. | CO2是直线型分子,推测CS2也是直线型分子 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com