
��֪�����µ������£�pH��Ϊ5��H2SO4��Һ��NH4Cl��Һ���ش��������⣺
��1����ȡ5mL������Һ���ֱ��ˮϡ����50mL��pH�ϴ����________��Һ
��2����ȡ5mL������Һ���ֱ���ȣ��¶���ͬ����pH��С����________��Һ
��3��H2SO4��Һ��NH4Cl��Һ����ˮ�������c(H+)֮��Ϊ__________
��4��ȡ5mL NH4Cl��Һ����ˮϡ����50mL��c(H+) ____________ 10-6mol��L-1���>������<����=������
c(NH4+)��c(H+)_______________�����������С�����䡱��
(1) H2SO4
(2) NH4Cl
(3) 10-4:1
(4) > ��С
��������
�����������1���Ȼ����Һ��pH=5����Ϊ笠����ӵ�ˮ����ɵģ�����ˮϡ�ͻ�ٽ��Ȼ��ˮ��������У�����������Ũ�ȵļ�С������pH����϶���������Һ����pH�ϴ����H2SO4��
��2�����ȴٽ��Ȼ�淋�ˮ�⣬��Һ��������Ũ������pH��С���������е�������Ũ�Ȳ��䣬����pH���䣬����pH��С����Һ��NH4Cl��Һ��
��3�����ˮ�ĵ������������ã����ε�ˮ���ˮ�ĵ�����ٽ����ã�������Һ��ˮ���������������Ũ�ȵ�����Һ�е�����������Ũ��Ϊ1��10-9mol/L�����Ȼ����Һ�е�ˮ���������������Ũ�ȼ�����Һ�е�������Ũ��Ϊ1��10-5mol/L�����Զ�����ˮ�������c(H+)֮��Ϊ1��10-9mol/L/1��10-5mol/L=10-4:1
��4���Ȼ��ϡ��ʱ��ˮ��ƽ�������ƶ�������ϡ��10������Һ��pH����ֵС��1��pH<6����c(H+)>10-6mol��L-1; c(NH4+)��c(H+)=c��NH3 ?H2O��/K����ˮϡ�ͣ�c��NH3 ?H2O����С�����Ա�ֵ��С��
���㣺������Һϡ�ͺ�pH�ı仯������Ũ�ȵı仯��ϵ���ж�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��У������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʵ����ʡ���ȡ��Ӧ�õȵ�˵������ȷ���ǣ� ��
A����8%����������Ũ�����30%������
B�����˺Ͳ����ϵĴ��̶��ǹ�������Ʒ
C�������ö����ЧӦ�����������Һ���Ȼ�����Һ
D�������������Ư���ԣ�����ˮ���ʹ��Ư��Ч������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�캣��ʡ�������Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������a mol/L CH3COOHϡ��Һ��b mol/L KOH ϡ��Һ�������ϣ������ж�һ���������
A����c(OH��)>c(H��)��a��b B����c(K��)>c(CH3COO��)��a<b
C����c(OH��)��c(H��)��a>b D����c(K��)<c(CH3COO��)��a<b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡЭ���������һ����Ӧ�Բ��������ۺϻ�ѧ���������棩 ���ͣ������
��14�֣���֪A(g)��B(g) C(g)��D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)��D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
��ش��������⣺
��1���÷�Ӧƽ�ⳣ������ʽΪK��______ ����H___0(ѡ�����������������)��
��2��830 ��ʱ����һ��5 L���ܱ������г���0.20 mol��A��0.80 mol��B������÷�Ӧ��ʼ��6 S��A��ƽ����Ӧ����v(A)��0.003 mol �� L-1�� S-1����6 Sʱc(A)��______ mol��L-1��C�����ʵ���Ϊ______ mol ��
��3�����루2����ͬ���¶ȡ�������A��B����·�Ӧ��һ��ʱ���ﵽƽ�⣬��ʱA��ת����Ϊ______�������ʱ����ܱ��������ٳ���1 mol�������ƽ��ʱA��ת����______ ��ѡ���������С���������䡱����
��4���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ______(����ȷѡ�����ĸ)��
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
��5��1200 ��ʱ��ӦC(g)��D(g) A(g)��B(g)��ƽ�ⳣ����ֵΪ______ ��
A(g)��B(g)��ƽ�ⳣ����ֵΪ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡЭ���������һ����Ӧ�Բ��������ۺϻ�ѧ���������棩 ���ͣ�ѡ����
������ͼʵ��װ�ã��ܵó���Ӧʵ����۵��ǣ� ��
| �� | �� | �� | ʵ����� | |
A | Ũ���� | CaCO3 | C6H5ONa | ���ԣ�����>̼��>���� | |
B | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� | |
C | H2O | ��ʯ | KMnO4 | ��Ȳ���л�ԭ�� | |
D | ���� | Na2CO3 | Na2SiO3 | �ǽ����ԣ�Cl��C��Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڻ�ͷ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����( )
A�������ʵ���Ũ�ȵ����������Һ������������Һ�������ϣ�c(S042-)>c(Na+)>C(NH4+)>c(OH-)=c(H+)
B��������0.4mol/LHB��Һ��0.2mol/LNaOH��Һ�������Ϻ���Һ��pH=3������Һ����Ũ�ȴ���
�����ϵ�� c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)
C���ڵ��з�̪��Һ�İ�ˮ�У�����NH4CI����Һǡ����ɫ�����ʱ��Һ��PH<7
D��pH=3�Ķ�Ԫ����H2R��Һ��pH=11��NaOH��Һ��Ϻ������ҺpH=7������Һ�У�2c(R2-)+c(HR-)=c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ѧ�ڻ�ͷ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͬλ��ʾ�ٷ������ڷ�Ӧ�������о������з�Ӧ��ת����ͬλ��ʾ�ٱ�ʾ��ȷ����
A��2Na218O2 + 2H2O = 4Nal8OH + O2��
B��NH4Cl + 2H2O  NH3��2H2O + HCl
NH3��2H2O + HCl
C��2KMnO4 + 5H218O2 + 3H2SO4= K2SO4 + 2MnSO4 + 518O2�� + 8H2O
D��K37ClO3 + 6HCl = K37Cl + 3Cl2�� + 3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ������ʮУ�����������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�����ĩ���п��ܺ���K2CO3��KNO3��NaNO2��K2SO3��Na2SO4��FeO��Fe2O3�е������֣�ijͬѧΪȷ���ù����ĩ�ijɷ֣�ȡ��������ʵ�飬ʵ����̼��������� �� ��
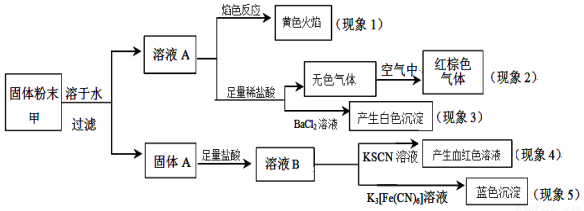
��ͬѧ�ó��Ľ�����ȷ����
A����������1���Ƴ��ù����ĩ�к�����Ԫ�أ���������Ԫ��
B����������2���Ƴ��ù����ĩ��һ������NaNO2
C����������3���Ƴ��ù����ĩ��һ������Na2SO4
D����������4������5���Ƴ��ù����ĩ��һ������FeO��Fe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ����9���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
(10��)����98%��Ũ���ᣨ�ѣ�1.84g/cm3�����Ƴ�Ũ��Ϊ0.5mol/L��ϡ����500mL��
��1��ѡ�õ���Ҫ�����У���Ͳ���ձ�������������ͷ�ιܣ�________��
��2�������������Ʋ�����
A ����Ͳ��ȡŨH2SO4 B �����ߵ�ҡ�� C �ý�ͷ�ιܼ�ˮ���̶�
D ϴ���������������� E��ϡ��ŨH2SO4 F������Һת������ƿ
����ȷ�IJ���˳��Ϊ��___________ ��
��3����Ҫ�ش��������⣺
������Ũ��������Ϊ_______mL��
�����ʵ������15mL ��20mL�� 50mL����Ͳ��Ӧѡ�� _____mL����Ͳ��ã���ȡʱ������Ͳ���ɾ�����ˮϴ����ֱ����ȡ��ʹ���Ƶ�Ũ��_____________��ƫ�ߡ�ƫ�͡���Ӱ�죩��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com