

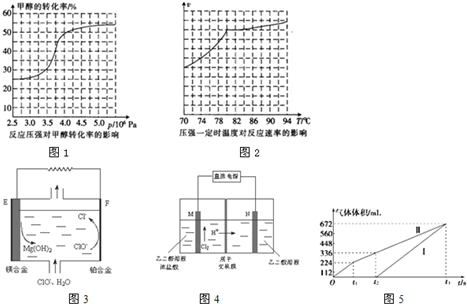
 .
. .
. .
.分析 A的相对分子质量为104,1mol A与足量的碳酸氢钠反应生成44.8L气体(标准状况),二氧化碳为$\frac{44.8L}{22.4L/mol}$=2mol,则A分子含有2个-COOH,去掉2个-COOH剩余总相对原子质量为104-45×2=14,剩余基团为CH2,故A的结构简式为HOOCCH2COOH.B的结构中含有醛基,结合信息④可知B为 ,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息④可知,D的结构简式为
,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息④可知,D的结构简式为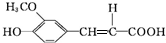 ,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,据此解答.
,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,据此解答.
解答 解:A的相对分子质量为104,1mol A与足量的碳酸氢钠反应生成44.8L气体(标准状况),二氧化碳为$\frac{44.8L}{22.4L/mol}$=2mol,则A分子含有2个-COOH,去掉2个-COOH剩余总相对原子质量为104-45×2=14,剩余基团为CH2,故A的结构简式为HOOCCH2COOH.B的结构中含有醛基,结合信息④可知B为 ,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息④可知,D的结构简式为
,C在一定条件下生成有机酸D,结合D的分子式可知,C脱去1分子二氧化碳生成D,由信息④可知,D的结构简式为 ,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,
,D与足量的E反应得到当归素,由当归素的分子式可知,D中羧基发生反应生成钠盐,故E为碳酸氢钠,
(1)A的结构简式为HOOCCH2COOH,分子式是C3H4O4,B的结构简式为 ,
,
故答案为:C3H4O4; ;
;
(2)C和酚羟基、碳碳双键,可以发生氧化反应,含有羧基,可以发生酯化反应,醚键很稳定,不易发生水解反应,不能发生消去反应,
故选:AD;
(3)反应②的化学方程式为: ,
,
故答案为: ;
;
(4)由上述分析可知,E的名称为碳酸氢钠,
故答案为:碳酸氢钠;
(5)符合下列条件的D( )的同分异构体:③1mol该同分异构体与足量的碳酸氢钠反应生成2mol CO2,含有2个羧基,①苯环上只有两个取代基;②苯环上的一氯代物只有两种,含有2个不同的取代基且处于对位,为-COOH、-CH2CH2COOH,或-COOH、-CH(CH3)COOH,或-CH3、-CH(COOH)2,或含有两个相同的取代基且处于邻位,取代基为-CH2COOH,故共有4种,结构简式为:
)的同分异构体:③1mol该同分异构体与足量的碳酸氢钠反应生成2mol CO2,含有2个羧基,①苯环上只有两个取代基;②苯环上的一氯代物只有两种,含有2个不同的取代基且处于对位,为-COOH、-CH2CH2COOH,或-COOH、-CH(CH3)COOH,或-CH3、-CH(COOH)2,或含有两个相同的取代基且处于邻位,取代基为-CH2COOH,故共有4种,结构简式为: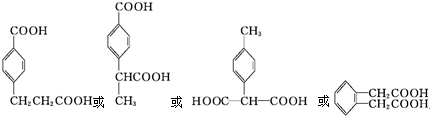 ,其中在核磁共振氢谱中只出现五组峰的物质的结构简式为:
,其中在核磁共振氢谱中只出现五组峰的物质的结构简式为: ,
,
故答案为:4; .
.
点评 本题考查有机物的推断与合成、有机物的结构与性质、同分异构体书写等,需要学生对给予的信息进行利用,充分利用给予的信息及C的结构与有机物分子式进行推断,侧重考查学生分析推理能力与知识迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
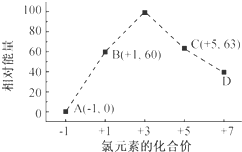
| A. | 40 | B. | 41 | C. | 42 | D. | 48 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2═I2+2Fe3++4Cl- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117 g该元素原子的物质的量为1 mol | |
| B. | 该元素一定为非金属元素 | |
| C. | 该元素在地球上的含量十分丰富 | |
| D. | 该元素的金属性可能比非金属性更明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
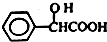 .工业上扁桃酸可以由烃A经过以下步骤合成得到:
.工业上扁桃酸可以由烃A经过以下步骤合成得到: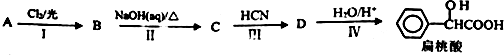
 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
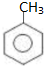
.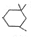 )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
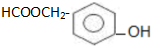 .
.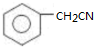 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸( )的合理路线.
)的合理路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
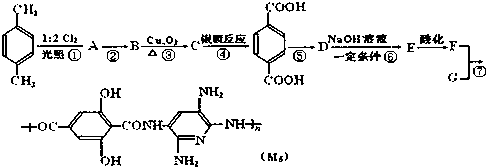
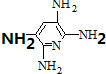 ,
, ;F的含氧官能团的名称有羧基、(酚)羟基.
;F的含氧官能团的名称有羧基、(酚)羟基.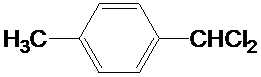 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 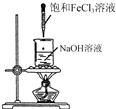 利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. | 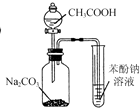 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com