
分析 (1)①SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ•mol-1
②2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ•mol-1
③2HI(g)=H2(g)+I2(g)△H=c kJ•mol-1
则::①×2+②+③×2得2H2O(g)=2H2(g)+O2(g),依据盖斯定律计算反应热;
(2)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量;
(3)根据反应热=反应物的总键能-生物物的总键能来解答.
解答 解:(1)①SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ•mol-1
②2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ•mol-1
③2HI(g)=H2(g)+I2(g)△H=c kJ•mol-1
则::①×2+②+③×2得2H2O(g)=2H2(g)+O2(g),依据盖斯定律:2H2O(g)=2H2(g)+O2(g)△H=2△H1+△H2+2△H3=(2a+b+2c) kJ/mol;
故答案为:2a+b+2c;
(2)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量,则甲烷的燃烧热化学反应方程式为CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ•mol-1 ;
(3)设1molNO分子中的化学键形成时可释放xkJ的能量,反应N2+O2?2NO中反应热=反应物的总键能-生物物的总键能=946kJ/mol+498kJ/mol-xkJ/mol×2=180kJ/mol;
解得:x=632,
故答案为:632.
点评 本题考查了反应热的计算、热化学方程式的书写,明确盖斯定律计算反应热方法、热化学方程式书写注意问题是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ 1mol 1mol 3.25g x L | |
| B. | Zn+2HCl═ZnCl2+H2↑ 65g 1L 3.25g x L | |
| C. | Zn+2HCl═ZnCl2+H2↑ 1mol 22.4L 0.05mol x L | |
| D. | Zn+2HCl═ZnCl2+H2↑ 65g 1mol 3.25g x L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
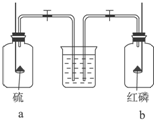
| A. | 水先进入a瓶 | B. | 水先进入b瓶 | ||
| C. | 水同时进入两瓶 | D. | 水不进入任何一瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
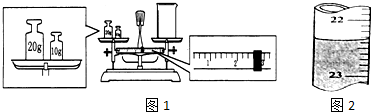
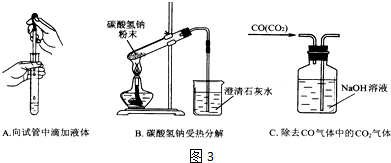
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取3.84g CuSO4粉末,加入250mL水 | |
| B. | 称取6.25g CuSO4•5H2O晶体,加水配成250mL溶液 | |
| C. | 称取4.0g CuSO4粉末,加入250mL水 | |
| D. | 称取4.0g CuSO4•5H2O晶体,加水配成250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
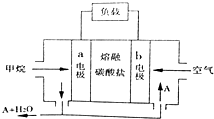
| A. | 正极的电极反应为:O2+2H2O+4e-=4OH- | |
| B. | 电池工作时,CO32-移向b电极 | |
| C. | 若实验过程中转移4mol电子,则该电池消耗11.2L CH4 | |
| D. | 为使电池稳定运行,电池的电解质组成应保持恒定.该电池工作时,应有物质A循环利用,A为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | CH2═CH2+HBr-→CH3-CH2Br | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 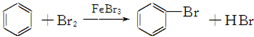 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:2 | ||
| C. | 该有机物的分子式为C2H6 | D. | 该化合物中一定含有氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com