
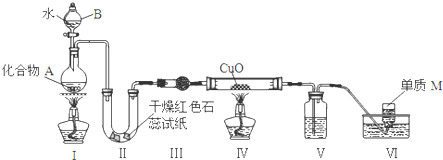
分析 (1)仪器B是分液漏斗,用来滴加反应物,控制反应速率;
(2)Ⅱ中的试纸变蓝,说明生成碱性气体氨气,Ⅳ中黑色粉末逐渐变为红色,并有M生成,Ⅳ为氨气与氧化铜反应,生成Cu,M为气体单质,为氮气,同时生成水.进入装置Ⅳ的气体应干燥,Ⅲ中试剂的作用是除去氨气中的水,故Ⅲ中的试剂为碱石灰;Ⅴ中的试剂的作用是除去剩余的氨气,故应为浓硫酸;
(3)装置连接顺序改变后,因为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,该反应有水生成,且氨气肯定不能完全反应;
(4)设该化合物的化学式为M3Nx,M的相对原子质量为R,利用关系式M3Nx~$\frac{x}{2}$N2,确定R与x的关系,x是M的化合价,只能取正整数,讨论确定M的相对原子质量,进而确定元素.
解答 解:(1)仪器B的名称是分液漏斗,其在该实验中有两个作用:一是加注液态反应物,另一个作用是通过滴加液体的速率控制反应速度
故答案为:分液漏斗;控制反应速度;
(2)Ⅱ中的试纸变蓝,说明生成了NH3,Ⅳ中黑色粉末逐渐变为红色并有M生成,生成Cu,M为气体单质,为氮气,同时生成水,发生了反应:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,
①Ⅲ中试剂的作用是除去氨气中的水,故应是碱石灰,故答案为:碱石灰;
②Ⅳ中黑色粉末逐渐变为红色并有M生成,生成Cu,M为气体单质,为氮气,同时生成水,发生了反应:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,
故答案为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O;
③Ⅴ中的试剂的作用是除去剩余的氨气,故应为浓硫酸,氨气和浓硫酸发生反应易引起倒吸,装置V的缺陷是没有防倒吸,
故答案为:除去没有被氧化完的氨气;没有防倒吸;
(3)装置连接顺序改变后,因为3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,该反应有水生成,且氨气肯定不能完全反应,剩余的氨气和水反应NH3•H2O,显碱性,使红色石蕊试纸变蓝,
故答案为:试纸变蓝;CuO与氨气反应生成的水和未反应的氨气形成氨水,使试纸变蓝;
(4)设该化合物的化学式为M3Nx,M的相对原子质量为R,则:
M3Nx~$\frac{x}{2}$N2
3R+14x 11.2 x L
2.5g 0.56 L
2.5×11.2x=(3R+14x)×0.56
整理得R=12x,因x是M的化合价,只能取正整数,R为12、24或36,则此元素只能为Mg,化合物A是Mg3N2,
A与水反应的化学方程式为:Mg3N2+6H2O═3 Mg(OH)2+2NH3↑,
故答案为:Mg3N2;Mg3N2+6H2O═3 Mg(OH)2+2NH3↑.
点评 本题主要考查元素化合物知识、化学计算、化学实验,(4)中根据生成的氨气确定N元素化合价,利用讨论的方法进行计算确定元素,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  能组成Zn、Cu原电池 | B. |  能证明非金属性C>Si | ||
| C. |  说明反应2NO2?N2O4△H>0 | D. |  白色沉淀为BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正反应速率增大、逆反应速率减小 | |
| C. | 增大CO(NH2)2的量,CO2的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量浓H2SO4 | B. | 硫酸钾固体 | C. | 醋酸钠固体 | D. | 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与126C互为同位素 | B. | 表示碳元素的一种核素 | ||
| C. | 质量数是13,核内有6个中子 | D. | 原子序数是6,核内有7个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com