
| A. | Zn为电池的正极 | |
| B. | 负极反应式为2FeO42-+10H++6e-═Fe2O3+5H2O | |
| C. | 该电池使用完不可随便丢弃,应深埋地下 | |
| D. | 电池工作时OH-向负极迁移 |
分析 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,原电池发生工作时,Zn被氧化,为原电池的负极,K2FeO4具有氧化性,为正极,碱性条件下被还原生成Fe(OH)3,结合电极方程式以及离子的定向移动解答该题.
解答 解:A.原电池发生工作时,Zn被氧化,为原电池的负极,故A错误;
B.KOH溶液为电解质溶液,则正极电极方程式为2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-,故B错误;
C.该电池含有重金属元素,埋在地下会污染地下水,故C错误;
D.电池工作时阴离子OH-向负极迁移,故D正确.
故选D.
点评 本题考查原电池知识,侧重考查学生的分析能力,题目较为基础,注意从元素化合价的角度分析,把握原电池与氧化还原反应的关系,难度不大.


科目:高中化学 来源: 题型:选择题
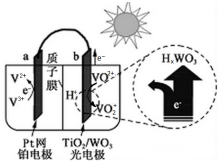
| A. | 光照时,太阳能主要转化为电能 | |
| B. | 光照时,b极的电极反应式为VO2+-e-+H2O═VO2++2H+ | |
| C. | 光照时,每转移5 mol电子,有5mol H+由b极区向a极区迁移 | |
| D. | 夜间,a极的电极反应式为V3++e-═V2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸和苯甲酸钠都是食品防腐剂 | |
| B. | 食用花生油和汽油都属于酯 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 毛发、鸡蛋清都不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
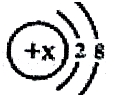 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 维生素是人体需要的营养物质.图为某品牌维生素C泡腾片说明书的部分内容.该泡腾片中添加的着色剂是喹啉黄,甜味剂是糖精钠.泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和碳酸氢钠反应释放出了气体.
维生素是人体需要的营养物质.图为某品牌维生素C泡腾片说明书的部分内容.该泡腾片中添加的着色剂是喹啉黄,甜味剂是糖精钠.泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和碳酸氢钠反应释放出了气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
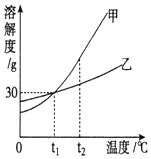 图是甲、乙两种固体物质的溶解度曲线.
图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
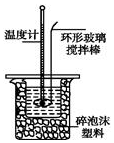 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com