
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油裂解目的是为了提高轻质油产量和质量 | |
| B. | 淀粉、纤维素、油脂都是高分子化合物 | |
| C. | 可以通过分液的方法分离乙酸乙酯和水的混合物 | |
| D. | 在紫外线、饱和(NH4)2SO4溶液、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
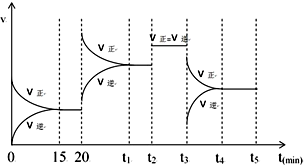 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:| 化学键 | N≡N键 | O=O键 | N$\stackrel{←}{=}$O键 |
| 键能kJ/•mol-1 | 945 | 498 | 630 |
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:D>B | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | B、D两元素可组成阴、阳离子个数比为1:1的化合物 | |
| D. | B、C、D三种元素可组成化学式为DCB2的化合物,其水溶液显碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com