
下列关于物质应用的说法错误的是
A.玻璃容器可长期盛放各种酸 B.纯碱可用于清洗油污
C.浓氨水可检验氯气管道漏气 D.Na2S可除去污水中的Cu2+
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=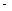 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=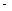 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
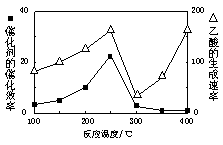
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
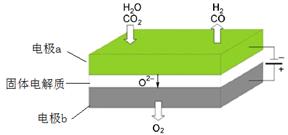
CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
________ +________
+________ +________
+________ →________
→________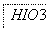 +________
+________
(2)整个过程中的还原剂是________.
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4层的颜色没有变 化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________________________________.
化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________________________________.
(4)加碘盐中含碘量为20 mg~50 mg/kg.制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可有于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究 。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L -1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体 产物是________。
产物是________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是________,现象是____________________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:_____________________________;
假设2:____________________________________;
假设3:________________________________。
②设计实验方案证明你的假设。
③实验过程
根据②中方案进行实验。在下表中写出实验步骤、预期现象与结论。
| 实验步骤 | 预期现象与结论 |
| 步骤1 | |
| 步骤2 | |
| 步骤3 | |
| …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热 反应 D.将锌粒投入Cu(NO3)2溶液
反应 D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示 仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是

A.a-b-c-d-e-e-f-g-h B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g D.a-c-b-d-e-h-i-f
查看答案和解析>>
科目:高中化学 来源: 题型:
X为某金属矿的主要成分,X具有下列转化关系(部分反应物、生成物没有列出)。

已知:1 mol X经一系列变化只生成A、B、C,且物质的量之比为1∶2∶1,X不含氧元素。请回答:
(1)X的化学式为________;
(2)写出物质A名称________;物质G名称:________;
(3)写出下列反应方程式:
C+E—→B+F__________________________________;
生成红色沉淀G___________________________________
___________________________ ______________________;
______________________;
(4)工业生产纯净C的方法是________;其阴极电极反应式是:________;
(5)已知反应②的热化学方程式为:2B(g)+O2(g)2D(g) Δ<0
该反应平衡常数表达式为:________;
升高温度 K值的变化是:________。(填“变大”、“变小”或“不变”)
K值的变化是:________。(填“变大”、“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
搭载“神舟”七号的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后发生反应生成的气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红棕色烟,产生红棕色烟的主要原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com