
����Ŀ�����ݻ���Ϊ0.5L�ļס��ҡ��������ܱ������зֱ����һ������A��B��������Ӧ��A(g)��xB(g)![]() 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ���ͼ����ʾ��
2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ���ͼ����ʾ��
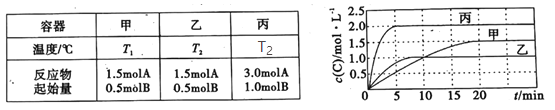
����˵����ȷ���ǣ� ��
A.T1< T2���Ҹ÷�ӦΪ���ȷ�Ӧ
B.x��2
C.��ƽ����¶Ȳ��䣬�ı��������ƽ�ⲻ�ƶ�
D.�÷�Ӧ����Ӧ�Ļ�ܴ����淴Ӧ�Ļ��
���𰸡�C
��������
A. ���ұȽϣ������ȴﵽƽ�⣬��Ӧ���ʿ죬����������ͬ������£�˵���ҵ��¶ȸߣ�����C��ƽ��Ũ�ȱȼͣ�˵�������¶�ƽ�������ƶ�������T1< T2���Ҹ÷�ӦΪ���ȷ�Ӧ����A����
B. ������Ƚϣ�����������ͬ�����ij�ʼŨ�����ҵ�2����ƽ��ʱC��Ũ��Ҳ���ҵ�2����˵����ѹƽ�ⲻ�ƶ����÷�Ӧǰ������ϵ������ͬ����x��1����B����
C. ����Bѡ��÷�Ӧǰ������ϵ������ͬ��ƽ����¶Ȳ��䣬�ı��������ƽ�ⲻ�ƶ�����C��ȷ��
D. ����Aѡ��÷�ӦΪ���ȷ�Ӧ����������Ӧ�Ļ��С���淴Ӧ�Ļ�ܣ���D����


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪п���仯����������������仯�������ơ���ͼ������Ϊ��Һ��pH��������ΪZn2+��[Zn(OH)4 ]2-�����ʵ���Ũ�ȵĶ�����25��ʱ������˵���в���ȷ����

A. ��ZnCl2��Һ�м����������������Һ����Ӧ�����ӷ���ʽΪZn2++4OH-=[Zn(OH)4]2-
B. ��Ҫ��ij��Һ����ȫ����Zn2+��ͨ�����Ե��ظ���Һ��pH��8.0��12.0֮��
C. pH=8.0��pH=12.0�����ַ�Һ�У�Zn2+Ũ��֮��Ϊ108
D. ���¶�ʱ��Zn(OH)2���ܶȻ�����(Ksp)Ϊ1��l0-10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ��õĻ�ԭ����ijУ������ѧС��̽�����ᱻ�������������⡣
ʵ��� | �Լ� | ��Ϻ� ��ҺpH | ���� ��1h����Һ�� | ||
�Թ� | �ι� | ||||
| a | 4mL0.01mol��L1 KMnO4��Һ������ŨH2SO4 | 2mL0.3mol��L1H2C2O4 ��Һ | 2 | ��Ϊ��ɫ |
b | 4mL0.01mol��L1KMnO4��Һ������ŨNaOH | 7 | �����Ա仯 | ||
c | 4mL0.01mol��L1 K2Cr2O7��Һ������ŨH2SO4 | 2 | �����Ա仯 | ||
d | 4mL0.01mol��L1 K2Cr2O7��Һ������ŨNaOH | 7 | �����Ա仯 | ||
��1��H2C2O4�Ƕ�Ԫ���ᣬд��H2C2O4����ˮ�ĵ��뷽��ʽ��_____________��
��2��ʵ��I�Թ�a��KMnO4���ձ���ԭΪMn2+���÷�Ӧ�����ӷ���ʽΪ��________��
��3�������ͳ����������ϣ�ʵ��I�Թ�c��H2C2O4��K2Cr2O7��Һ��Ӧ������ʱ�������ɣ�������MnO2�ɴٽ�H2C2O4��K2Cr2O7�ķ�Ӧ�����ݴ����ϣ����������������ʵ��֤ʵ����һ�㡣
ʵ�� | ʵ��III | ʵ��IV | |
ʵ����� |
|
|
|
ʵ������ | 6 min�������ȫ�ܽ⣬��Һ��ɫ��dz���¶Ȳ��� | 6 min�����δ�ܽ⣬��Һ��ɫ�����Ա仯 | 6 min�����δ�ܽ⣬��Һ��ɫ�����Ա仯 |
ʵ��IV��Ŀ���ǣ�_______________________��
��4�������ȶ�ʵ��II��������̽����������Һ��Cr2O72- Ũ�ȱ仯��ͼ��

�갺Ͳ̲���Ϊ�˱仯��ͨ����������ʵ�ֵġ�
����i��MnO2��H2C2O4��Ӧ������Mn2+��
����ii��__________________________________��
�ٲ������ϣ���Һ��Mn2+�ܱ�PbO2����ΪMnO4-����Թ���i���ɲ������·���֤ʵ����0.0001molMnO2���뵽6mL____________�У�������ȫ�ܽ⣻����ȡ��������Һ���������PbO2���壬��ַ�Ӧ���ã��۲쵽_______________��
�ڲ����������ʵ�鷽��֤ʵ�˹���ii���������ǵ�ʵ�鷽����________��
��5���ۺ�����ʵ���֪�����ᷢ��������Ӧ��������__________________�йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ����ȷ���ǣ� ��
A.CO(g)��ȼ������283.0kJ��mol��1�����ʾCO(g)��ȼ���ȵ��Ȼ�ѧ����ʽΪ��2CO(g)��O2(g)��2CO2(g) ��H����283.0kJ��mol��1
B.����Ӧ��������������������������ʱ��Ϊ���ȷ�Ӧ������������������ȷ�Ӧ�����������ʱ����Ϊ���ȷ�Ӧ
C.��ϡ��Һ�У�H��(aq)��OH��(aq)��H2O(l) ��H����57.3kJ��mol��1��������0.5molH2SO4��Ũ�����뺬lmolNaOH����Һ��ϣ��ų�����������57.3kJ
D.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)��O2(g)��2H2O(l) ��H����571.6kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ����(��֪Ksp(AgCl)��4.0��10��10��Ksp(AgBr)��4.9��10��13��Ksp(Ag2CrO4)��2.0��10��12)
A.0.lmol��L��1 NH4HS��Һ���У�c(NH4��)��c(NH3��H2O)>c(HS��)��c(S2��)
B.��AgCl��AgBr�ı�����Һ�������ϣ��ټ���������ŨAgNO3��Һ��AgCl������������AgBr����
C.��Ũ�Ⱦ�Ϊ1��10��3mol/L��KCl��K2CrO4���Һ�еμ�1��10��3mol/LAgNO3��Һ��CrO42�����γɳ���
D.�����£�pH��4.75��Ũ�Ⱦ�Ϊ0.l mol/L��CH3COOH��CH3COONa�����Һ��c(CH3COO��)��c(OH��)>c(CH3COOH)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijŨ�ȵ�NaOH��Һ�ζ�20.00 mL��Ũ�ȵ�CH3COOH��Һ�����õζ�������ͼ������˵����ȷ���ǣ� ��

A.c����Һ��c(Na+)��c(CH3COO��)��1��1
B.a��b�����Ӧ�Ĵ���ĵ���ƽ�ⳣ����a��b
C.a�������Һ��Ũ��Ϊ1.0��10�C3 mol��L�C1
D.�����¶ȣ�d����ҺpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Fe/Ni���ϲ�����ȥ����Ⱦˮ���NO3��Ni�����뷴Ӧ�������ڲ��ϱ���Ļ���λ������������Ӧ������λ�㱻����������ռ�ݻᵼ�����ʼ�����NH4+��ռ�ݻ���λ�㣩����Ӧ������ͼ��ʾ��
��1�����Ի����У�����Fe/Niȥ��NO3��������������ii����������
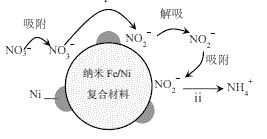
��.NO3+Fe+2H+=NO2+Fe2++H2O
��.�� +�� +��H+=��Fe2++�� +�� ______
��2����ʼpH=2.0�ķ�Һ��Ӧ15min���ִ�����ɫ��״����˺�ܿ��ɺ��ɫ����ϻ�ѧ������������仯���̵�ԭ��_________��
��3��ˮ���ʼpH��Ӱ�췴Ӧ���ʣ���ͬpH����������Һ������Fe/Ni��Ӧʱ����Һ����ʱ��ı仯��ͼ1��ʾ����ע��c0(NO3)Ϊ��ʼʱNO3��Ũ�ȡ���
��Ϊ�ﵽ���ȥ���ʣ�Ӧ��ˮ��ij�ʼpH=______��
��t<15min��pH=2.0����Һ��Ӧ������죬t>15min���䷴Ӧ����Ѹ�ٽ��ͣ�ԭ��ֱ���_______��

��4���ܵ���ָ��Һ�������ƶ������к�����Ũ��֮�ͣ�����Fe/Ni����ijŨ����������Һʱ����ʱ��ı仯��ͼ2��ʾ��40minʱ�ܵ����ϳ�ʼʱ�½������ܵ�ԭ����_____��
��5�����õ����������ˮ���е�NO3����������N2�ݳ�����װ�ü�ת��ͼ��ͼ��ʾ��
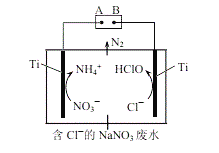
�������ĵ缫��ӦʽΪ___________��
������N2�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c(CH3COO��)��c(Na+)=________(��ȷ��ֵ)��
(2)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ___________________________________��
(3)д��ʹ����ĭ�����ʱ������Ӧ�����ӷ���ʽ_________________________________��
(4)������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ��_______(������������������������������)����Һ��c(Na��) _______c(CH3COO��)(���� >�� �� ����������<��)��
(5)pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ��_______(������������������������������)��
(6)25��ʱ�����ΪVa��pH=a��ijһԪǿ����Һ�����ΪVb��pH=b��ijһԪǿ����Һ���Ȼ�Ϻ���Һ��pH=7����֪b=2a��Va��Vb����a��ȡֵ��ΧΪ________��
(7)����a������ b������ c�������������ȫ�кͺ������ʵ�����NaOH����Һ��������ͬpH��������������Һ������ɴ�С��˳����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2C2O4)�Ƕ�Ԫ���ᣬKHC2O4��Һ�����ԡ���10mL 0.01mol��L-1��H2C2O4��Һ�μ�0.01mol��L-1KOH��ҺV(mL)���ش��������⡣
��1����V<10mLʱ����Ӧ�����ӷ���ʽΪ___��
��2����V=10mLʱ����Һ��HC2O4-��C2O42-��H2C2O4��H+��Ũ�ȴӴ�С��˳��Ϊ___��
��3����V=a mLʱ����Һ������Ũ�������¹�ϵ��c(K+)=2c(C2O42-)+(HC2O4-)����V=b mLʱ����Һ������Ũ�������¹�ϵ��c(K+)= c(C2O42-)+c(HC2O4-)+c(H2C2O4)����a___b(����<����=������>��)��
��4����V=20mLʱ���ٵ���NaOH��Һ������Һ��![]() ��ֵ��___(�������������С������������)��
��ֵ��___(�������������С������������)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com