
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(2)将氯气通入品红溶液,品红褪色,起作用的微粒是生成的次氯酸,SO2和Cl2在溶液中发生了氧化还原反应,生成硫酸和盐酸,离子反应为SO2+Cl2+2H2O═4H++SO42-+2Cl-;
(3)以氯气和石灰乳为原料制造漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,漂白粉的有效成分是Ca(ClO)2;
(4)向FeI2溶液中通入过量的氯气时,还原性的碘离子和亚铁离子全部反应,由此书写化学方程式;
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2↑+Cl2+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2↑+Cl2+2H2O;
(2)将氯气通入品红溶液,品红褪色,起作用的微粒是生成的次氯酸,SO2和Cl2在溶液中发生了氧化还原反应,生成硫酸和盐酸,离子反应为SO2+Cl2+2H2O═4H++SO42-+2Cl-,故答案为:次氯酸;SO2+Cl2+2H2O═4H++SO42-+2Cl-;
(3)以氯气和石灰乳为原料制造漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,漂白粉的有效成分是Ca(ClO)2,故答案为:Ca(ClO)2;
(4)向FeI2溶液中通入过量的氯气时,还原性的碘离子和亚铁离子全部反应,即溶液中发生的化学反应可表示为2FeI2+3Cl2=2FeCl3+2I2,故答案为:2FeI2+3Cl2=2FeCl3+2I2.
点评 本题考查了氯气及其化合物性质、氯气制备和漂白粉制备原理等知识点,主要是化学方程式书写,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 强电解质 | 弱电解质 | 非电解质 | |
| A | 钠 | 碳酸 | 氨气 |
| B | 氯化钠 | 水 | Cu |
| C | 硫酸钡 | 氢氧化钙 | 硅酸 |
| D | 烧碱 | 次氯酸 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
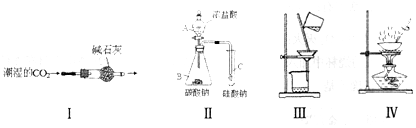
| A. | 用Ⅰ图装置,可得到干燥的CO2 | |
| B. | 用Ⅱ图装置,若C中出现白色沉淀,则可说明H2CO3的酸性强于H2SiO3 | |
| C. | 用Ⅲ图装置,可除去氯化钠溶液中的泥沙 | |
| D. | 用Ⅳ图装置,分离乙醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不法商贩用甲醛浸泡海鲜可使蛋白质变性 | |
| B. | “人造鸡蛋”与“鸡蛋”的主要成分相同 | |
| C. | 地沟油可转化为生物柴油、航空煤油、重新利用 | |
| D. | 发射神舟十一号载人飞船的燃料偏二甲肼(C2H8N2)属于有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅>金刚石>碳化硅 | B. | CsCl>KCl>NaCl | ||
| C. | SiO2>CO2>He | D. | Br2>I2>He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
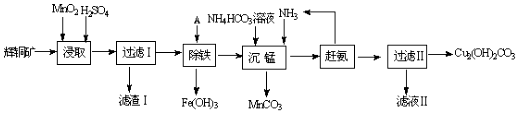
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com