
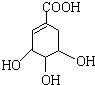
 ç�����Ǻϳ����������е�ҩ��--��ƣ�Tamiflu����ԭ��֮һ��ç������A��һ���칹�壮A�Ľṹ��ʽ���£�
ç�����Ǻϳ����������е�ҩ��--��ƣ�Tamiflu����ԭ��֮һ��ç������A��һ���칹�壮A�Ľṹ��ʽ���£�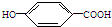 �����䷴Ӧ��������ȥ��Ӧ����ѧ����ʽ��
�����䷴Ӧ��������ȥ��Ӧ����ѧ����ʽ��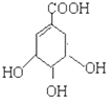 $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$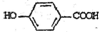 +2H2O��
+2H2O��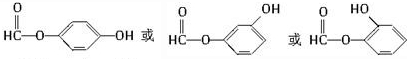 ��
�� ���� ��1�����ݽṹ��ʽ��ȷ������ʽ��
��2�������Ȼ����������ԣ������������ơ�̼�����Ʒ�Ӧ�������Ȼ����ǻ����������Ʒ�Ӧ��
��3����-OH�ɷ�����ȥ��Ӧ��
��4��B��ͬ���칹���мȺ��з��ǻ��ֺ�����������Ӧ��ͬ���칹���� ��
��
��� �⣺��1���ɽṹ��ʽ��֪A�ķ���ʽΪC7H10O5���ʴ�Ϊ��C7H10O5��
��2������1���Ȼ�����1mol A������������Һ��ȫ��Ӧ����Ҫ����NaOH�����ʵ�����1mol������1���Ȼ���3���ǻ�����1molA������Na������Ӧ������� 2molH2��A��NaHCO3�����ķ�Ӧ���Ա�ʾΪ��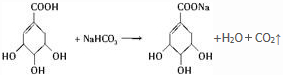 �����ɶ�����̼�����Ϊ$\frac{17.4g}{174g/mol}$=2.24L��
�����ɶ�����̼�����Ϊ$\frac{17.4g}{174g/mol}$=2.24L��
�ʴ�Ϊ��1��2��2.24L��
��3��A��Ũ�����ϼ��ȷ�����ȥ��Ӧ���γɺ�C=C�IJ����ͻ������ԭ������CH3CH2OH��Ũ���Ṳ������CH2=CH2������ʽΪ $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$ +2H2O��
+2H2O��
�ʴ�Ϊ����ȥ��Ӧ�� $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$ +2H2O��
+2H2O��
��4��B�ķ���ʽΪC7H6O3������ֻ�ܺ���1��-COO-����������1��-OH�����ǻ��������ߵ����λ�����ڡ��䡢�������������Ӧ���ʵķֱ�Ϊ ��
��
�ʴ�Ϊ��3�� ��
��
���� �����ۺϿ����л���Ľṹ�����ʣ��Ǹ߿��еij������ͣ������ۺ���ǿ���ѶȽϴ�ѧ����˼ά��������˸��ߵ�Ҫ������ע�ػ���֪ʶ������ѵ����ͬʱ�������������������ͽ��ⷽ����ָ����ѵ��������������ѧ������˼ά�����ͳ���˼ά���������ѧ���ķ������⡢��������������


 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���¶Ȳ��䣬�ڰ�ˮ�м�������NH4Cl���壮��ˮ�ĵ���Ⱥ͵���ƽ�ⳣ������С | |
| B�� | �μӼ����Ժ�ɫ����Һ��NH4+��NO3-��I-��Cl-���Դ������� | |
| C�� | ������pH���������NaOH��Һ�Ͱ�ˮ�ֱ��ˮϡ��m����n����ϡ�ͺ�������Һ��pH����ȣ�m��n | |
| D�� | ij�¶��£�ˮ�����ӻ�����Kw=10-13���ڴ��¶��£���pH=12��NaOH��ҺVaL��pH=2������VbL��ϣ�������Һ�����ԣ���Va��Vb=10��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+��CH3COO-��Ca2+��Cl- | B�� | Fe3+��Ag+��SO42-��NO3- | ||
| C�� | Cu2+��H+��S2-��NO3- | D�� | I-��Fe3+��K+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | FeBr2��Һ�м��������ˮ��2Fe2++Cl2=2Fe3++2Cl- | |
| B�� | ���ۺ�FeCl3��Һ��Ӧ��Fe+Fe3+=2Fe2+ | |
| C�� | ���ۺ���ϡHNO3��Ӧ��Fe+NO3-+4H+=Fe3++NO��+2H2O | |
| D�� | Mg��HCO3��2��Һ�����NaOH��Һ��Ӧ��Mg2++2HCO3-+2OH-=MgCO3��+CO32-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NO2���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⣮
������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NO2���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH��NaCl��NaAlO2 | B�� | KNO3��NaCl��CH3COONa | ||
| C�� | Na2S����NH4��2SO3��AgNO3 | D�� | Ba��NO3��2��FeSO4��NH4HCO3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com