
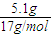 =0.3 mol,
=0.3 mol,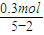 =0.1mol,所以NO体积是:0.1 mol×22.4 L/mol=2.24 L;
=0.1mol,所以NO体积是:0.1 mol×22.4 L/mol=2.24 L;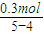 =0.3mol,所以NO2体积是:0.3 mol×22.4 L/mol=6.72 L;因为得到是混合气体,因此体积在二者之间,选项B符合.
=0.3mol,所以NO2体积是:0.3 mol×22.4 L/mol=6.72 L;因为得到是混合气体,因此体积在二者之间,选项B符合.

 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市普陀区高三下学期二模化学试卷(解析版) 题型:计算题
金属及其化合物变化多,用途广。请完成下列计算:
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g。它在空气中灼烧后的产物中Mg3N2的质量分数是 (用a、b表示,只考虑空气中氮气、氧气参与反应)。
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度。
②计算并确定此种硬铝的化学式。
(3)取5.1g Al-Mg合金与200mL 1mol·L-1的NaOH(aq)充分反应,产生气体a L。过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全。过滤、洗涤、干燥、灼烧,得到固体5.1 g。则a = ,V = 。(气体体积均为标准状况)
(4)向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6 mol·L-1 HNO3(aq),恰好完全溶解,同时收集到1120 mL NO(标准状况)。通过计算推断混合粉末中Cu的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com