
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 含有amolFeBr2的溶液中,通入0.4amolCl2:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用两块铜片作电极电解盐酸:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+ |
分析 A.氧化铁和HI发生氧化还原反应生成碘、碘化亚铁;
B.浓盐酸、双氧水都能被酸性高锰酸钾溶液氧化;
C.还原性Fe2+>Br-,所以通入氯气时先和亚铁离子反应生成铁离子,后和溴离子生成溴,反应方程式为2Fe2++Cl2=2Cl-+2Fe3+、2Br-+Cl2=Br2+2Cl-,amol亚铁离子被氯气氧化需要0.5amol氯气,通入0.4amol氯气,则通入的氯气不足量,所以发生的反应为氯气和亚铁离子的反应;
D.用Cu作电极电解稀盐酸,阳极上Cu失电子生成铜离子,阴极上氢离子得电子生成氢气.
解答 解:A.氧化铁和HI发生氧化还原反应生成碘、碘化亚铁,离子方程式为Fe2O3+6H++2I-═2Fe2++I2+3H2O,故A正确;
B.浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故B错误;
C.还原性Fe2+>Br-,所以通入氯气时先和亚铁离子反应生成铁离子,后和溴离子生成溴,反应方程式为2Fe2++Cl2=2Cl-+2Fe3+、2Br-+Cl2=Br2+2Cl-,amol亚铁离子被氯气氧化需要0.5amol氯气,通入0.4amol氯气,则通入的氯气不足量,所以发生的反应为氯气和亚铁离子的反应,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D.用Cu作电极电解稀盐酸,阳极上Cu失电子生成铜离子,阴极上氢离子得电子生成氢气,离子方程式为Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+,故D正确;
故选B.
点评 本题考查离子方程式正误判断,为高频考点,涉及氧化还原反应、电解原理,明确反应原理、离子反应先后顺序是解本题关键,注意B中浓盐酸能被酸性高锰酸钾溶液氧化,注意D中活泼金属作阳极上阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.


科目:高中化学 来源: 题型:填空题
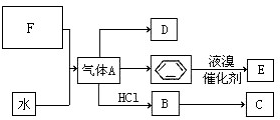 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应;
+HBr,其反应类型为取代反应; ,其反应类型为加聚反应.
,其反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用AgNO3溶液可以鉴别KCl和KI | |
| B. | SO2使溴水褪色与乙烯使KMnO4溶液褪色原理相同 | |
| C. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| D. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅(半导体材料) | B. | 二氧化硅(制光导纤维) | ||
| C. | Na2Si03 (用作粘合剂,俗称水玻璃) | D. | Al(OH)3(用作胃药,俗称人造刚玉) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | ||
| C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com