
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:简答题
Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)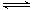 CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________ 。
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________________。
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | a | b |
III | 207 | 0.20 | 0.090 | 0.090 |
(4) 容器I中的反应达到平衡时所需的时间_______(填“大于”“小于”或等于)容器II中的。
(5) a=_____
(6) 下列说法中能说明该反应达到平衡状态的是__________。(填字母)
A. 容器中压强不变 B. 混合气体中c(CH3OCH3) 不变
C. 混合气体的密度不变 D. 单位时间内生成1 mol CH3OCH3 同时消耗2molCH3OH
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)  CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1
反应②:2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
则下列m与n的关系中,正确的是__________(填字母)。
A. n﹥2m B. m﹥2 n C. 2m﹥n D. m﹥3n
查看答案和解析>>
科目:高中化学 来源:2017届江西省协作体高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)反应②是________________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式_________________;
每消耗6.4g甲醇转移的电子数为_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
由二氧化硅制高纯硅的流程如下,下列判断中错误的是
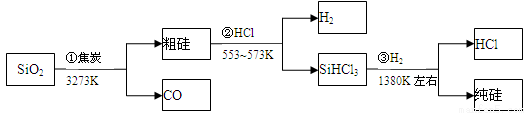
A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
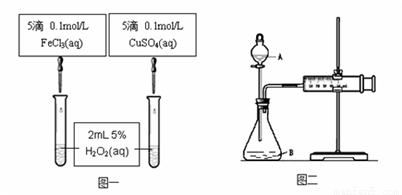
(1) 图一可通过观察____________________现象来定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是__________________,你认为还可以作其他何种改进? _____________________。
(2) 图二可用于定量比较反应的快慢,检查图二装置气密性的方法是________________。
利用图二做实验时需测量的数据是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为
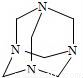
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 酯类物质是形成水果香味的主要成分
B. 可用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C. 乙酸乙酯、油脂与烧碱溶液反应均有醇生成
D. 可向蔗糖的水解液中直接加入银氨溶液检验蔗糖是否发生水解
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高二上学期期末学分认定考试B卷化学试卷(解析版) 题型:简答题
酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是_____________(填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是___________(填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是____________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________________。
③ V1和V2的关系:V1___________V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___________________。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)=_____mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较________(填溶质的化学式)溶液中NH 的浓度更大,其原因是__________________
的浓度更大,其原因是__________________
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:填空题
过氧化钠、过氧化镁、过氧化氢都是重要的过氧化物。回答下列问题:
(1)过氧化镁不溶于水,但易溶于稀酸.广泛用作胃药,治疗胃酸过多.试写出过氧化镁与胃酸反应的离子方程式:_____________________。
(2)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为___________________;高铁酸钠能用作新型净水剂的原理是_________________;
(3)取少量含Fe2+、H+溶液于试管中,滴加几滴硫氰化钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,其中包括的反应有_______________、______________(写离子方程式);继续加H2O2,红色逐渐褪去且有气泡产生,反应原理如下:(已知SCN-中S为-2价,配平方程式)
___H2O2+____ SCN--→____SO42-+____CO2↑+____N2↑+____H2O+____ H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com