


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、HClO的结构式:H-Cl-O |
B、CO2的比例模型: |
C、146C的原子结构示意图: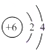 |
D、 的名称:3-甲基-2-丁烯 的名称:3-甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
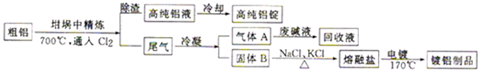
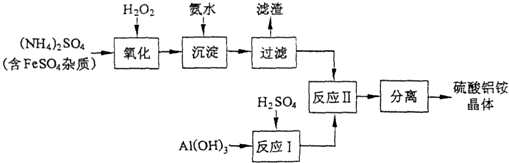
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| (i)B2H6 |
| (ii)H2O2/OH- |
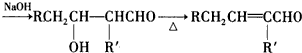

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小:Z>Y>X>W |
| B、由W元素形成的单质一定是原子晶体,其熔沸点很高 |
| C、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
| D、Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、到达平衡时A和B中NO2气体体积分数相同 |
| B、若在A、B中再充入与初始量相等的NO2,则达到平衡时A、B中NO2转化率都增大 |
| C、若气球的体积不再改变,表明B中反应已达到平衡 |
| D、室温下,若设法使A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时B中气体的颜色较深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com