
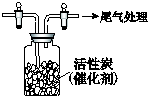
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
| ||
| ||


科目:高中化学 来源: 题型:
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2,且熔化时破坏的是离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
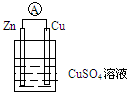 根据如图装置回答:
根据如图装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ |
| B、Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ |
| C、醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |
| D、MgCO3跟稀硫酸反应:MgCO3+2H++SO42-═MgSO4↓+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com