
某课外化学兴趣小组在实验室制备氨气,并进行有关氨气的性质探究.

(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
①应该选用的仪器及装置有(填字母)________.
②生石灰与氯化铵反应生成氨气的化学方程式为________.
(2)该小组同学设计如下图所示装置探究氨气的还原性.

①氨催化氧化的化学方程式为________.
该反应所用的催化剂一般选用________(填写化合物名称).
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式可能为________.
(3)该小组同学以氨气和二氧化碳为原料拟制备碳酸氢铵.
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.选择合适的方案并说明原因.__________同学方案比较合理,因为________________.
②检验产物中有NH![]() 的方法为________________.
的方法为________________.
(1)①G、D、E、C(2分)
②CaO+2NH4Cl CaCl2+2NH3↑+H2O(2分),
CaCl2+2NH3↑+H2O(2分),
(2)①4NH3+5O2 4NO+6H2O(2分) 三氧化二铬(1分)(其它合理的都给分)
4NO+6H2O(2分) 三氧化二铬(1分)(其它合理的都给分)
②NH4NO3(1分)
(3)①乙(1分)
二氧化碳在水中溶解度较小,先通入二氧化碳,再通入氨气,生成的产物量少,且易生成碳酸铵;
氨气在水中溶解度很大,先通入氨气,再通入二氧化碳,生成的产物量多,且易生成碳酸氢铵;(1分)应选择乙同学方案.(以划线部分为主,以下同)
②取少量产物放入试管中,加入少许NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明产物中有NH![]() .(2分)
.(2分)


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
| O | 2- 4 |
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 | ||
| 第一步 | 向溶液中滴加过量的HNO3溶液 | 检验 CO32- CO32- 的存在 |
2H++CO32-═CO2↑+H2O 2H++CO32-═CO2↑+H2O | ||
| 第二步 | 继续滴加过量的 Ba(NO3)2 Ba(NO3)2 溶液 |
检验S
|
|||
| 第三步 | 过滤,再向溶液中滴加 AgNO3 AgNO3 溶液 |
检验 Cl- Cl- 的存在 |
Ag++Cl-═AgCl↓ |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
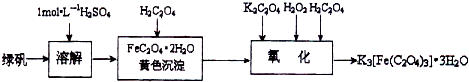
查看答案和解析>>
科目:高中化学 来源: 题型:
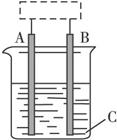
图11-3
(1)该装置的名称是____________。
(2)A、B中至少有一种是金属____________,接____________。
(3)C溶液中含有____________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省武威第五中学高一11月月考化学试卷(带解析) 题型:填空题
(9分)某中学化学兴趣小组在课外活动时,对学校附近的甲、乙两条河流的水质进行了多次检测。第一组检测甲河流的水质结果如下:
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl K2SO4 Na2CO3 NaCl |
| 第二次 | KCl BaCl2 Na2SO4 K2CO3 |
| 第三次 | Na2SO4 KCl K2CO3 NaCl |
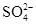 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
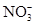 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com