
【题目】如图是微粒物质的量变化图,常温下向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液,下列说法正确的是
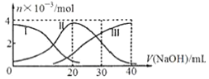
A.H2A在水中的电离方程式是:H2A→2H++A2-
B.当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当V(NaOH)=30mL时,则有:2c(H+)+c(HA-)+2c(H2A)= c(A2-)+2c(OH-)
D.当V(NaOH)=40mL时,其溶液中水的电离受到抑制
【答案】B
【解析】
A.根据图知,溶液中存在HA-、H2A、A2-,说明该酸是二元弱酸,在水溶液中部分电离,所以其二元酸的电离方程式为H2AH++HA-,HA- H++ A2-,故A错误;
B. 当V(NaOH)=20mL时,二者恰好完全反应生成NaHA,溶液中存在HA-、H2A、A2-,说明 HA-能电离和水解,且c(H2A)< c(A2-),说明其电离程度大于水解程度,导致溶液呈酸性,其电离和水解程度都较小,则溶液中离子浓度大小顺序是: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;
C.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH= Na2A+H2O ,溶液主要为等物质量的NaHA、Na2A 的混合溶液,根据电荷守恒得: c(Na+)+ c(H+)= c(HA-)+ 2c(A2-)+ c(OH-)①,物料守恒:3c(HA-)+ 3c(A2-)+ 3 c(H2A)=2 c(Na+)②,根据①×2+②得:2c(H+)+c(HA-)+3c(H2A)= c(A2-)+2c(OH-),故C错误;
D.当V(NaOH)=40mL时,二者恰好完全反应生成强碱弱酸盐Na2A ,含有弱离子的盐促进水电离,所以Na2A 促进水电离,故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH1<0,平衡常数为K1;
2ClNO(g) ΔH1<0,平衡常数为K1;
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
(2)为研究不同条件对反应①的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应①达到平衡。测得10 min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=__________mol,NO的转化率α1=___________。其他条件保持不变,反应①在恒压条件下进行,平衡时NO的转化率为α2,α1____α2(填“>”“<”或“=”),平衡常数K1______________(填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,该电池发生的总反应为2Li+P2VP·nI2![]() P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
A.该电池放电时,锂电极发生还原反应
B.该电池放电时,碘离子移向正极
C.P2VP和I2的复合物是绝缘体,不能导电,充电时与外电源的负极相连
D.放电时正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间的变化如图所示,如图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间的变化如图所示,如图可得出的正确结论是
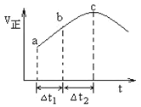
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段大于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限,TF菌在酸性溶液中可实现天然气的催化脱硫,其原理图如图所示。
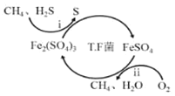
(1)写出涉及铁化合物的两个离子方程式:___;___。
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,从平衡移动的角度解释主要原因是:___。
(3)室温下,如果将0.2molNH4Cl、0.1molNaOH全部溶于水,形成混合溶液(假设无损失)
①___和___两种粒子的物质的量之和等于0.2mol。
②___和____两种子的物质的量之和比OH-多0.1mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能如下四种关系。
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)=c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__,上述离子浓度大小序中正确的是__(选填序号)。
②若上述关系中C是正确的,则该溶质的化学式是__。
③若该溶液是由体积相等的稀盐酸和氮永混含而成,且恰好呈中性,则混合前c(HCl)__(填“>”“<”或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)___c(Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
甲 乙
乙 丙
丙 丁
丁
A. 装置甲中试剂X可以选择生石灰 B. 装置乙作为反应过程的安全瓶
C. 装置丙制备水合肼时氨气从b口进入 D. 装置丁可用于吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素显__价。
(2)以上反应中的氧化剂为__,当有1molCuI参与反应时,转移电子_mol。
(3)标明上述反应电子转移的方向和数目____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com