
分析 (1)制取乙酸乙酯的反应在试管中进行,可以对试管直接加热;乙醛的银镜反应温度不宜过高,需要在水浴中反应;而石油的蒸馏需要在蒸馏烧瓶中进行,给蒸馏烧瓶加热需要垫上石棉网,苯酚和氯化铁溶液常温反应,据此进行解答;
(2)A.酒精与水互溶,不能使用酒精萃取碘水中的碘;
B.液化石油气、汽油和石蜡都是石油产品,石油是烃类组成的化合物;
C.有银镜产生,则证明淀粉已经水解,若证明淀粉是否完全水解,需要加入碘水检验;
D.乙醇的消去反应,温度应该控制在170℃,若140℃生成的是乙醚;
E.溴乙烷在氢氧化钠的水溶液中加热发生水解反应,加入硝酸银溶液前需要加入酸溶液中和溶液至溶液为酸性.
解答 解:①乙酸乙酯的制备中,反应在试管中进行,可以直接给试管中的混合液体加热,所以A正确,
故答案为:A;
②乙醛的银镜反应中,反应温度不宜过高,需要在控制反应温度,所以需要水浴加热,
故答案为:C;
③石油的分馏操作中,用于加热的反应装置为蒸馏烧瓶,给蒸馏烧瓶加热时需要垫上石棉网,
故答案为:B;
④苯酚溶液与FeCl3溶液常温下反应生成紫色溶液,
故答案为:D;
(2)A.由于酒精与原溶液的溶剂水互溶,无法通过酒精萃取碘水中的碘,故A错误;
B.液化石油气、汽油和石蜡都是石油产品,石油是烃类组成的化合物;液化石油气、汽油和石蜡的主要成分都是碳氢化合物,故B正确;
C.用水解后的淀粉溶液做银镜反应,若有银镜产生,则证明淀粉已经水解,无法证明淀粉完全分解;若证明淀粉是否完全水解,需要加入碘水进行检验,故C错误;
D.用酒精和浓硫酸制取乙烯时,浓硫酸的体积和酒精体积的比=3:1,加热温度是170℃,如果加热温度是140℃就生成乙醚,故D错误;
E.为证明溴乙烷分子中溴元素的存在,可向溴乙烷中加入NaOH溶液加热,溴乙烷发生水解反应生成溴离子,加入稀硝酸至溶液呈酸性后,再滴入AgNO3溶液看是否有淡黄色沉淀,该操作合理,故E正确;
故选BE.
点评 本题考查了乙酸乙酯的制取、石油的分馏、乙醛的有机反应等知识,题目难度中等,试题涉及的知识点较多,注意掌握化学实验基本操作方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:填空题
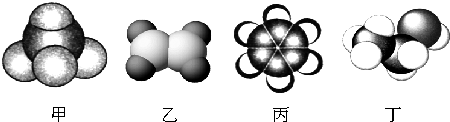
 ;乙的结构式为
;乙的结构式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
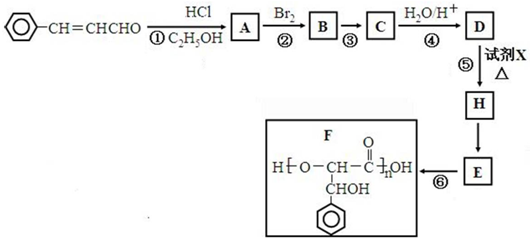
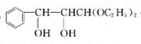 .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$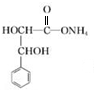 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.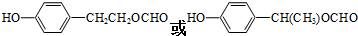 . (任写一种)
. (任写一种)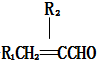
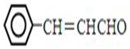 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=$\stackrel{Br_{2}}{→}$CH2BrH2Br.
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=$\stackrel{Br_{2}}{→}$CH2BrH2Br.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与果糖、淀粉和纤维素分别为同分异构体 | |
| B. | 若某有机物在氧气中充分燃烧生成CO2和H2O物质的量相等,则该有机物是乙烯 | |
| C. | 燃烧乙烷、环丙烷(C3H6)混合气体,所产生的CO2的量一定小于燃烧相同质量的丙烯所产生的CO2 | |
| D. | 相同质量的乙烯和乙醇在氧气中充分燃烧,消耗的氧气相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
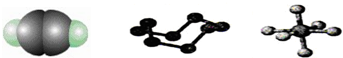
| A. | 32 g S8分子中含有0.125 mol σ键 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 1 mol C2H2分子中有3 mol σ键和2 mol π键 | |
| D. | 1 mol S8中含有8 mol S-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的PH增大 | B. | 溶液中的Zn2+浓度增大 | ||
| C. | 溶液中的SO42- 浓度增大 | D. | 溶液的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
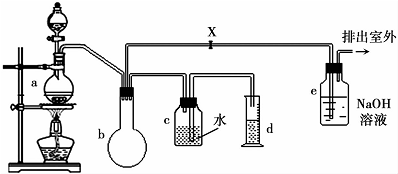
| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
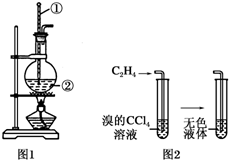 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com