
| A. | 50mL 3mol/L KCl溶液 | B. | 75 mL 2mol/L CaCl2溶液 | ||
| C. | 100 mL 0.5mol/L BaCl2溶液 | D. | 50mL 1mol/L AlCl3溶液 |
分析 氯离子的物质的量浓度与溶液体积大小无关,与溶质化学式组成及溶质浓度有关,如:150mL 1mol/L NaCl溶液中c(Cl-)=1mol/L,据此进行解答.
解答 解:150mL 1mol/L NaCl溶液中c(Cl-)=1mol/L,
A.50mL 3mol/L KCl溶液中氯离子浓度为3mol/L,故A错误;
B.75 mL 2mol/L CaCl2溶液中氯离子的浓度为:2mol/L×2=4mol/L,故B错误;
C.100 mL 0.5mol/L BaCl2溶液中氯离子浓度为:0.5mol/L×2=1mol/L,故C正确;
D.50mL 1mol/L AlCl3溶液中氯离子的浓度为:1mol/L×3=3mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意离子的浓度与溶液体积大小无关,为易错点,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、OH-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 小苏打 | 干冰 |
| B | 蒸馏水 | 氨水 | 火碱 | 二氧化硫 |
| C | 硫酸 | 胆矾 | 纯碱 | 氨气 |
| D | 硝酸 | 食盐 | 氢氧化钠溶液 | 生石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
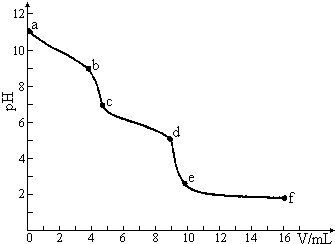 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)=c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1mol/L醋酸溶液加水稀释后,所有离子浓度均减小 | |
| B. | Na2CO3溶液中,一定有2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1 mol•L-1HCN溶液与1mol•L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com