
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 1.5molNO2与足量H2O反应,转移的电子数为1.5NA | |
| C. | 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA | |
| D. | 含有H2SO41mol的浓硫酸与足量铜反应,生成SO2的分子数为0.5NA |
分析 A、氯气和铁反应后变为-1价;
B、二氧化氮和水的反应中,3mol二氧化氮转移2mol电子;
C、NO2和N2O4的最简式均为NO2;
D、铜只能与浓硫酸反应,与稀硫酸不反应.
解答 解:A、氯气和铁反应后变为-1价,故1mol氯气反应后转移2mol电子即2NA个,故A错误;
B、二氧化氮和水的反应中,3mol二氧化氮转移2mol电子,故1.5mol二氧化氮转移1mol电子即1NA个,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,则含有3mol原子即3NA个,故C正确;
D、铜只能与浓硫酸反应,与稀硫酸不反应,故1mol硫酸不能反应完全,则生成的二氧化硫分子个数小于0.5NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
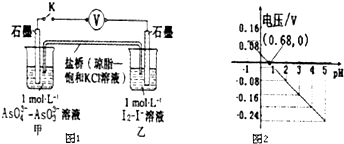
| A. | 调节pH可以改变反应的方向 | |
| B. | pH=0.68 时,反应处于平衡状态 | |
| C. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| D. | pH>0.68时,氧化性I2>AsO${\;}_{4}^{3-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、Ag+ | B. | H+、HCO3-、Na+、Cl- | ||
| C. | Na+、OH-、Ba2+、CO32- | D. | Mg2+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中可能有两个羧基和一个羟基 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中肯定有碳碳双键 | |
| D. | X中可能有三个羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
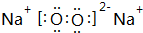 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 1.0L0.1mol•L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 | |
| C. | 7.8gNa2O2与足量CO2反应,转移的电子数为0.1NA | |
| D. | 向仅含0.2molFeI2的溶液中持续通入氯气,当有0.1molFe2+被氧化时,需通入标况下C121.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
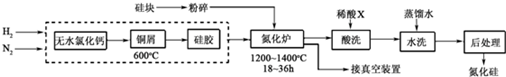
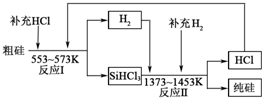
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2(CuCl2) | B. | AgNO3(Ag2O) | C. | NaCl(NaCl) | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com