
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g)CO(g)+H2(g) 。下列条件的改变对反应速率几乎没有影响的是( )
A. 增加C的量;
B. 减少CO的量;
C. 升高反应体系的温度;
D. 保持压强不变,充入He以增大体积
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示。
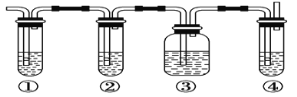
图中①、②、③、④装置可盛放的试剂依次是
A. 品红溶液 、NaOH溶液、浓H2SO4 、酸性KMnO4溶液
B. 品红溶液 、NaOH溶液、品红溶液 、酸性KMnO4溶液
C. 酸性KMnO4溶液 、NaOH溶液、品红溶液 、溴水
D. 浓H2SO4 、NaOH溶液、品红溶液 、溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_______________。检验氨气已装满的方法是_______________。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______(填序号)也可形成喷泉实验。
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气

(3)完成氨催化氧化生成为NO的反应方程式_________,产物NO有毒,不能排入空气中,若将NO和氧气一起通入水中能生成硝酸的化学方程式:________
(4)2.56gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:_______________(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边___________________(填操作名称)、过滤、洗涤。
④高铁酸钠(Na2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与漂白液(主要成分NaClO)在强碱性条件下反应可制取Na 2FeO4,反应的离子方程式为___________________________。
(2) ①SiO2和NaOH焙烧制备硅酸钠,可采用的装置为_______________(填代号)。

②过量CO2通入到硅酸钠的溶液中,然后加热蒸干,再高温灼烧,最后所得固体成分___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,其氧化物是形成酸雨的重要原因 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
(1)X能形成多种常见单质,在硬度最大的单质中,原子的杂化方式为_______。
(2)Z位于元素周期表的位置是___,Y的氢化物空间构型是_____。
(3)在H-Y、H-Z两种共价键中,键的极性较强的是______,X所在周期元素中氢化物最稳定的是______(用具体元素符号表示)。
(4)下列有关X2H4的说法正确的是_____。
A.分子中所有原子都满足8电子稳定结构
B.每个分子中σ键和π键数目之比为4:1
C.它是由极性键和非极性键构成的非极性分子
D.分子的空间构型为直线形
(5)向含有W2+的溶液中逐滴加入氨水至过量,期间出现的现象是________,写出最后所得配离子的结构式,要求标出配位键____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应生成硼酸(H3BO3)的化学方程式_____________。为提高浸出速率,除适当增加硫酸的浓度外,还可采取的措施有_________(写出两条)。
(2)利用_______的磁性,可将其从“矿粉”中分离。“浸渣”中的物质是______(写化学式)。
(3) “净化除杂”需先加H2O2溶液,作用是(用离子方程式表示)_______。然后再调节溶液的pH约为5,目的是________。
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中正确的是( )
A. 分子组成是C5H10O2属于羧酸的同分异构体有5种
B. C8H10中只有3种属于芳香烃的同分异构体
C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D. 新戊烷的二氯代物只有1种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制小苏打(NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl)的操作中,应在饱和食盐水中( )
A.先通入CO2,达到饱和后再通入NH3
B.先通入NH3,达到饱和后再通入CO2
C.CO2和NH3同时通入
D.以上三种方法都行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com