
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ? | |||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |


科目:高中化学 来源: 题型:
| A、Fe(OH)3与氢硫酸溶液混合:Fe(OH)3+3 H+═Fe3++3H2O |
| B、1mol?L-1的NaAlO2溶液和2.5mol?L-1的HCl等体积互相均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
| C、向硫酸铝按[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-═AlO2-+2BaSO4↓+NH3?H2O+2H2O |
| D、碳酸氢镁溶液中加入足量氢氧化钠:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 |
| B、淀粉、纤维素、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、只用水就能鉴别苯、乙醇和四氯化碳 |
| D、分子式C4H8Cl2的有机物,分子中含2个甲基的同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

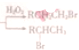 (R:烃基或氧原子,R′:烃基)
(R:烃基或氧原子,R′:烃基)
| OH- |
| -H2O |
 写出以丙烯和
写出以丙烯和 为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2
为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2| O2 |
| 催化剂 |
| O2 |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com