
| A、氨水能与H2SO4反应生成(NH4)2SO4 |
| B、铵盐受热易分解 |
| C、0.1 mol/L的氨水可使酚酞试液变红 |
| D、0.1mol/L NH4Cl溶液的pH约为5 |


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
A、2H2O2
| ||||
B、NH4Cl
| ||||
C、2Al+Fe2O3
| ||||
D、Cu+2H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入碘化钾溶液中:Cl2+2I-═2Cl-+I2 |
| B、氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O |
| C、石灰石加入稀盐酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、铜加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2g |
| B、17.6g |
| C、在11.2g和17.6g之间 |
| D、大于17.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去.已知X、Y、Z是日常生活中常见金属单质,X由地壳中含量最高的金属元素组成;D、E是常见气态非金属单质,其中D呈黄绿色.A的焰色反应呈紫色(透过蓝色钴玻璃),F的稀溶液呈蓝色.
如图所示的是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去.已知X、Y、Z是日常生活中常见金属单质,X由地壳中含量最高的金属元素组成;D、E是常见气态非金属单质,其中D呈黄绿色.A的焰色反应呈紫色(透过蓝色钴玻璃),F的稀溶液呈蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
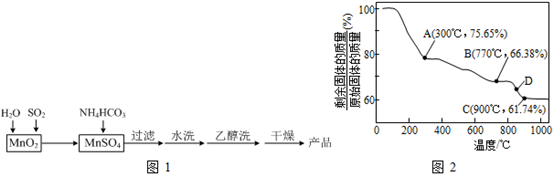
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com