
| A. | 原子半径大小顺序:D>C>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含有共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最低的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |
分析 A、B、C、D是原子序数依次增大的短周期主族元素,A与C,B与D分别同主族,由原子序数可知,B处于第二周期、C与D处于第三周期,且A,C元素的质子数之和是B、D元素质子数之和的一半,则A只能为H元素,C为Na,可推知B为O元素、D为S元素,E为Cl,结合元素周期律与元素化合物性质解答.
解答 解:A、B、C、D是原子序数依次增大的短周期主族元素,A与C,B与D分别同主族,由原子序数可知,B处于第二周期、C与D处于第三周期,且A,C元素的质子数之和是B、D元素质子数之和的一半,则A只能为H元素,C为Na,可推知B为O元素、D为S元素,E为Cl.
A.所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>S>O>H,故A错误;
B.由B和C元素组成的化合物为氧化钠、过氧化钠,过氧化钠既含有离子键,又含共价键,故B正确;
C.元素B、D、E与A形成的化合物分别为H2O、H2S、HCl,常温下H2S、HCl为气体,而H2O分子之间存在氢键,为液体,沸点最高,故C错误;
D.元素D与C形成的化合物为Na2S,硫离子易被氧气氧化而变质,故D错误,
故选B.
点评 本题考查了原子结构和元素性质,为高频考点,根推断元素是解题关键,侧重考查学生分析推理能力,注意熟练掌握短周期元素.


科目:高中化学 来源: 题型:选择题
| A. | 放射元素 | B. | ⅦA族元素 | C. | 卤化银 | D. | ⅠA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能是酸 | B. | 只能是碱 | ||
| C. | 可能是酸也可能是碱 | D. | 只能是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1的AlCl3溶液 | B. | 20 mL 0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
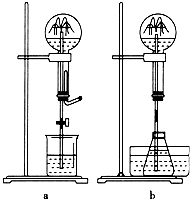 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

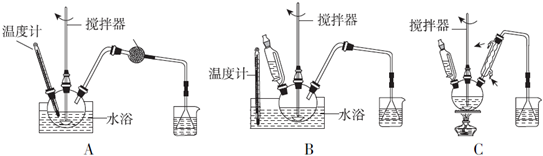
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸,应将水慢慢注入盛有浓硫酸的烧杯中并搅拌 | |
| B. | 酒精灯洒出的酒精万一在桌上着火,应立即用湿抹布扑盖 | |
| C. | 碱溶液沾到皮肤上,应尽快用抹布擦拭干净,再涂上稀盐酸 | |
| D. | 氢气还原氧化铜实验结束时,为节约氢气,应先停止氢气再停止加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com