
[化学——选修5:有机化学基础]抗疟新药青蒿素的结构简式如下图所示。
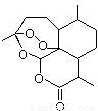
(1)青蒿素的分子式为____。
(2)为了引入过氧基(-O-O-),需要在有机合成中引入羟基,引入羟基的反应类型有____。(选填编号)
①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤还原反应
天然香草醛(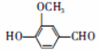 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图:
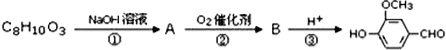
(3)M的结构简式为____。
(4)步骤①③的作用是____。
(5)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的结构简式____。
①苯环二取代;②能水解;③能发生银镜反应;④与FeCl3溶液发生显色反应。
(6)苄基乙醛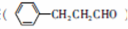 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
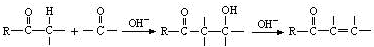
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| X | ||
| M | Y | Z |
| A. | 原子半径大小为Z>Y>M>X | |
| B. | 最高价氧化物的水化物的酸性强弱为X>Z>Y>M | |
| C. | 均形成简单离子,简单离子半径大小为M>Y>Z>X | |
| D. | X、M或Y、M不可能同为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )
实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )| 选项 | 试剂a | 试剂b | 试剂c | c中的现象 |
| A | 浓氨水 | 生石灰 | 硝酸银溶液 | 先沉淀后消失 |
| B | 稀硝酸 | 银 | 水 | 试管口无明显现象 |
| C | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 溶液颜色没有变化 |
| D | 稀硫酸 | 纯碱 | 硅酸钠溶液 | 先沉淀后消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素X有三种同位素 | |
| B. | 其中一种同位素质量数为36 | |
| C. | 质量数为35的同位素原子的质量分数为75% | |
| D. | 元素单质X2的平均式量为71 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:实验题
碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
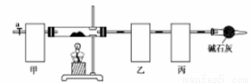
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)
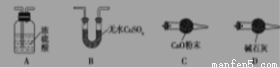
甲: 乙: 丙:
甲装置的作用是 。
(2)步骤②中省略的实验操作为 ;
步骤③中乙装置的现象为 ;
步骤④中缓缓通入空气数分钟的目的是 。
(3)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。
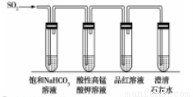
①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:选择题
我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A.①中水银“积变又还成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com