
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
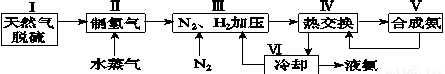
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。(填序号)
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)下图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。

(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:
________________________________________________________________________。
(12分)(1)2NH4HS+O2一定条件2NH3·H2O+2S
(2)a 90%
(3)14.5%
(4)Ⅳ 对原料气加压;分离液氨后,未反应的N2、H2循环使用
【解析】
试题分析:(1)一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,吸收液是氨水,所以再生反应的化学方程式为2NH4HS+O2一定条件2NH3·H2O+2S;
(2)a、升高温度,平衡向吸热反应方向移动,所以升高温度平衡正向移动,氢气的百分含量增加,同时反应速率加快,正确;b、增大水蒸气浓度,反应速率加快,平衡正向移动,但氢气的物质的量增加小于水蒸气物质的量增加值,所以氢气的百分含量降低,错误;c、加入催化剂,反应速率加快,但对平衡无影响,氢气的百分含量不变,错误;d、降低压强,反应速率减慢,平衡正向移动,氢气的百分含量增加,错误,答案选a;1 mol CO和H2的混合气体中CO的物质的量是0.2mol,则氢气的物质的量是0.8mol,设CO转化的物质的量是xmol,则生成xmol的二氧化碳和氢气,则0.2-x+x+0.8+x=1.18,解得x=0.18,所以CO的转化率是0.18mol/0.2mol×100%=90%;
(3)根据图可知,当氢气与氮气的投料比是3时,氨气的平衡体积分数是42%,设开始时氮气的物质的量是1mol,则氢气的物质的量是3mol,平衡时氮气的物质的量减少xmol,生成氨气是2xmol,则2x/(1-x+3-3x+2x) ×100%=42%,解得x=0.59,则平衡时氮气的体积分数是(1-x)/(1-x+3-3x+2x) ×100%=14.5%;
(4)合成氨是放热反应,所以可以预热氮气、氢气,所以合成氨放出的能量得到充分利用的主要步骤是热交换步骤IV;提高合成氨原料总转化率就是使平衡一直正向移动,则可以对原料气加压,平衡正向移动;分离液氨后,平衡正向移动;未反应的N2、H2循环使用,可以增大原料的转化率。
考点:考查化学平衡的计算,化学方程式的书写


科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:选择题
同温同压下,1体积X2气体与3体积Y2气体生成2体积气体化合物,则该化合物的化学式为
A.XY B.XY3 C.X3Y D.X2Y3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省宝鸡市岐山县高一上学期期中质量检测化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写中,正确的是
A.氯化铜溶液与铁粉反应:Cu2+ +Fe=Fe2+ +Cu
B.稀硫酸与铁粉反应:2Fe+6H+ =2Fe3++3H2↑
C.氢氧化钡溶液与稀硫酸反应:Ba2+ +SO =BaSO4↓
=BaSO4↓
D.碳酸钙与盐酸反应: +2H+ =H2O+CO2↑
+2H+ =H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:选择题
在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)( )
A.11.52 B.11.70
C.11.82 D.12.00
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:选择题
下列各组离子能大量共存,且溶液为无色透明的是( )
A.Al3+、AlO2-、NO3-、Cl-
B.CrO42-、H+、K+、NO3-
C.Ba2+、Na+、HCO3-、OH-
D.K+、SO42-、S2-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高二上学期10月月考化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法中,正确的是( )
A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高二上学期10月月考化学试卷(解析版) 题型:选择题
已知某可逆反应aA(g) + bB(g)  cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的( )
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的( )

A.正反应为吸热反应
B.降低温度,正反应速率增大
C.a + b < c + d
D.增大压强,B转化率增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高一上学期10月月考化学试卷(解析版) 题型:选择题
MgCl2、KCl、K2SO4 3种盐配成混合液后,若溶液中n(K+)=1.5 mol、
n(Mg2+)=0.5 mol、n(Cl-)=1.5 mol,则溶液中n(SO42-)应为
A.0.5 mol B.0.25 mol
C.0.15 mol D.1 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省五校协作体高二上学期期中化学试卷(解析版) 题型:选择题
化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用 ②研发易降解的生物农药 ③应用高效洁净的能源转化技术
④田间焚烧秸秆 ⑤推广使用节能环保材料
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com