
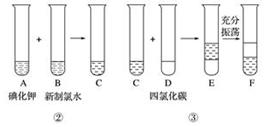
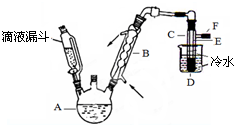
 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
分析 (1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅;
(2)根据装置图可知仪器的名称,D为冷凝器,E为接受馏分的锥形瓶;
(3)C1控制反应混合溶液的温度,C2处的温度计是控制馏出成分的沸点;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(5)根据条件 ①含有与正丁醇相同的官能团,即有醇羟基,②一定条件下能被氧化成醛,说明羟基连在CH2上,据此写出符合条件的正丁醇的同分异构体;
(6)设正丁醛的理论产量为xg,根据关系式C4H10O~C4H8O列计算出理论产量,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)因为浓硫酸的密度大,能将Na2Cr2O7溶液加到浓硫酸中,容易发生迸溅伤人,
故答案为:不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人;
(2)D仪器的名称直形冷凝管,E仪器为锥形瓶;
故答案为:分直形冷凝管;锥形瓶;
(3)温度计的作用是,C1控制反应混合溶液的温度,C2处的温度计是控制馏出成分的沸点,测定蒸馏出来气体的温度,
故答案为:C1控制反应温度;C2测定蒸馏出来气体的温度;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化;
(5)根据条件 ①含有与正丁醇相同的官能团,即有醇羟基,②一定条件下能被氧化成醛,说明羟基连在CH2上,则符合条件的正丁醇的同分异构体为(CH3)2CHCH2OH,
故答案为:(CH3)2CHCH2OH;
(6)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=$\frac{74×2}{72×4}$×100%=51%,
故答案为:51%.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度中等,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
| 苯 | 78 | 78 | 0.88 |
| 氯苯 | 112.5 | 132.2 | 1.1 |
| 邻二氯苯 | 147 | 180.4 | 1.3 |

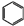 +2HCl+O2$→_{210℃}^{催化剂}$2
+2HCl+O2$→_{210℃}^{催化剂}$2 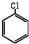 +2 H2O.
+2 H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
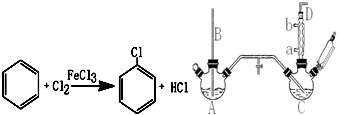
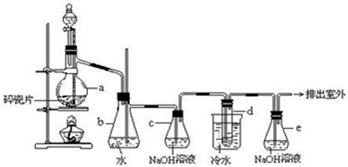
 图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.
图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| 水溶性 | 易溶 | 难溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2++2Br- | |
| C. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=2Fe3++I2+4Br- | |
| D. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述微观粒子的物理量 | |
| B. | 1 mol任何物质都含有Na个原子 | |
| C. | 0.5 mol H2O中含有的原子数目为1.5Na | |
| D. | 64g氧相当于2mol氧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com