
分析 NaHCO3溶液存在水的电离平衡、弱酸根离子的水解平衡、电离平衡;
NaHCO3溶液水解碱性;
NaHSO4溶液电离显酸性.
解答 解:NaHCO3溶液中存在H2O?H++OH-、HCO3-+H2O?+H2CO3+OH-、HCO3-+H2O?H3O++CO32-;
NaHCO3溶液显碱性的原因为NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;
NaHSO4溶液显酸性的原因为NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显碱性,
故答案为:H2O?H++OH-、HCO3-+H2O?+H2CO3+OH-、HCO3-+H2O?H3O++CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显碱性;
点评 本题考查电离与水解,为高频考点,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②⑤⑥ | C. | ②③④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+Na2CO3、HCl+NaHCO3 | B. | BaCl2+Na2SO4、Ba(OH)2+NaHSO4 | ||
| C. | KOH+HCl、Ba(OH)2+H2SO4 | D. | 石灰石与硝酸、石灰石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中滴入CuSO4溶液 OH-+Cu2+=Cu(OH)2↓ | |
| B. | 乙醛发生银镜反应CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4+2Ag↓+3NH3+H2O | |
| C. | 醋酸与碳酸钠溶液反应 CO32-+2H+=H2O+CO2↑ | |
| D. | 溴乙烷中滴入AgNO3溶液 Ag++Br-=AgBr↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
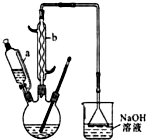 己二酸
己二酸 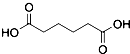 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图: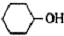 +8HNO3→3
+8HNO3→3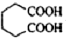 +8NO↑+7H2O
+8NO↑+7H2O| 物资 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇,不溶于苯. | 146 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com