
| A. | NaHSO4在水溶液中的电离方程式:NaHSO4═Na++HSO4- | |
| B. | H2SO3的电离方程式:H2SO3?2H++SO32- | |
| C. | CaCO3的电离方程式:CaCO3═Ca2++CO32- | |
| D. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
分析 A.为强电解质,完全电离出钠离子、氢离子和硫酸根离子;
B.为弱电解质,电离以第一步为主;
C.为强电解质,完全电离;
D.水解分步进行,以第一步为主.
解答 解:A.NaHSO4在水溶液中的电离方程式为NaHSO4═H++Na++SO42-,故A错误;
B.H2SO3的电离方程式为H2SO3?H++HSO3-,故B错误;
C.CaCO3的电离方程式为CaCO3═Ca2++CO32-,故C正确;
D.CO32-的水解方程式为CO32-+H2O?HCO3-+OH-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解与电离的离子反应考查,注意电解质的强弱判断及电荷守恒,题目难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
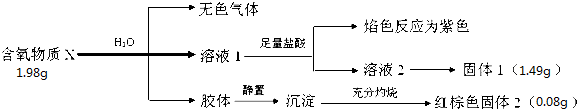
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气前,必须验纯 | |
| B. | 大块的金属钠着火,用水浇灭 | |
| C. | 实验结束后,用嘴吹灭酒精灯 | |
| D. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式为:K=$\frac{c(CO)•({H}_{2}O)}{c(C{O}_{2})•({H}_{2})}$ | |
| B. | 升高温度,正反应速率增大,逆反应速率减小 | |
| C. | 容器内CO和H20的浓度始终相等 | |
| D. | 容器内的压强始终不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
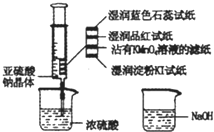 如图,在注射器中加人少量Na2SO3晶体,并吸人少f浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加人少量Na2SO3晶体,并吸人少f浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润淀粉碘化钾试纸未变蓝说明SO2不能将I-还 原为I2 | |
| B. | 品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性 | |
| C. | 实验后,可把注射器中的物质推人NaOH溶液,以减少环境污染 | |
| D. | 蓝色石蕊试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
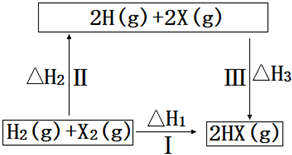
| A. | 2H(g)+2X(g)=2HX(g)△H3<0 | |
| B. | 途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | 途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定 | |
| D. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 用铜电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-═Mg(OH)2↓,3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 钢铁发生吸氧腐蚀生成铁锈:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com