
【题目】作为食品添加剂中的防腐剂G和W,可经下列反应路线得到(部分反应条件略)。
G的制备:


(1)为什么不直接由A→E→G,增加反应A→B和D→E的目的是___________________。
(2)E→G的化学方程式为____________________________________________________。
(3)A是苯酚的同系物,若向苯酚钠溶液中通入少量的CO2气体,会出现__________现象 ,写出该反应的化学方程式_________________________________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。

已知:①SnCl2、SnCl4有关物理性质:

②SnCl4极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是_________________________________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________________________________;②____________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________。
(5)滴定分析产品中2价Sn(Ⅱ)的含量:用分析天平称取5.000g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000mol·L-1的碘标准溶液滴定至终点时消耗20.00mL,则产品中Sn(Ⅱ)的含量为___________。(已知Sn2++I2=2I-+Sn4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。

(1)配平焙烧时化学反应: □MnO2+□_____+□O2![]() □K2MnO4+□H2O;__________
□K2MnO4+□H2O;__________
(2)滤渣II的成分有_______(化学式);第一次通CO2不能用稀盐酸代替的原因是_________。
(3)第二次通入过量CO2生成MnO2的离子方程式为_________。
(4)将滤液Ⅲ进行一系列操作得KMnO4。由下图可知,从滤液Ⅲ得到KMnO4需经过_____、______、洗涤等操作。

(5)工业上按上述流程连续生产。含MnO2a%的软锰矿1吨,理论上最多可制KMnO4___吨。
(6)利用电解法可得到更纯的KMnO4。用惰性电极电解滤液II。
①电解槽阳极反应式为____________;
②阳极还可能有气体产生,该气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下实验探究金属与浓硫酸反应。试回答下列问题。

(1)利用上图装置研究铜与浓硫酸反应,反应化学方程式为_________; B装置的目的是______;x溶液为___________。
(2)将上述实验中的铜改为黄铜(铜锌合金),实验后阶段可观察到倒立漏斗边缘有气体冒出,且越来越快。该气体可能为____,气体产生越来越快的原因可能是_____(答一点即可)。
验证该气体的实验方案如下:

①装置连接顺序:x→_________;
②能证明上述假设成立的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛索洛芬钠可用于类风湿性关节炎、肩周炎等炎症的消炎,其合成路线如下:

已知:A分子式为C8H8,E的分子式为C4H6
i.![]()
ii.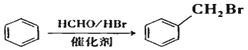
iii.
(1)A属于芳香烃,其名称为_____________。
(2)反应②的反应类型是____________________。
(3)B的结构简式是_________________________。
(4)D中含有的官能团名称____________。
(5)反应①的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是很活泼的金属,在空气中燃烧的产物是Na2O2。Na2O的制取可以通过如下反应完成:Na+NaNO3 → Na2O+N2↑(未配平)。
请回答下列问题:
(1)为何不用钠在空气中氧化生成Na2O?____。
(2)在上述反应中,N2有何作用?____。
(3)制取Na2O时由于设备密封性不好而进入了少量空气,导致制得的Na2O产品中含有Na2O2杂质。某学生设计了以下实验方案来测定该样品中Na2O的质量分数,其操作流程和实验数据如图:
![]()
![]()
![]()
![]()
![]()
该氧化钠样品中Na2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重晶石(主要成分是BaSO4,含Al、Fe等元素的杂质)为原料制备产品(BaCl2·2H2O)的一种流程如下:

已知:滤液2主要含BaCl2,还含有AlCl3、FeCl3和HCl等杂质。298K下,Fe(OH)3、Al(OH)3完全沉淀的pH依次为3.0和5.4。
回答下列问题:
(1)高温焙烧时将重晶石粉碎的目的是______________________。若4.66 g BaSO4完全反应转移9.632×1022个电子,写出BaSO4与C反应的化学方程式:______________________。
(2)“固体”(微溶于水)与盐酸反应生成的一种气体通入CuSO4溶液中产生黑色沉淀,则生成该气体的离子方程式为______________________。滤渣3的成分是___________(填化学式)。
(3)加入BaCO3的目的是____________________________________________。
(4)常温下,Fe3+沉淀完全[溶液中c(Fe3+)=1×10-5mol·L-1]时溶液的pH=3,则Fe(OH)3的Ksp约为_____。
(5)滤液4经蒸发浓缩、降温结晶、过滤,洗涤和干燥,得到产品。采用电化学法以过滤后的废液为原料制备Ba(OH)2,实现资源综合利用和环境保护。气体X的电子式为____________________;写出阴极的电极反应式:__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含氢原子数与___个H2O分子中所含氢原子数相等。
(2)含0.4molFe3+的Fe2(SO4)3中所含的SO42-的物质的量是___。
(3)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为____。
(4)2.3gNa中含___mole-,在反应中生成Na+共失去___mole-。
(5)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是__________________________(写一点);浸取铬时反应的离子方程式为_______________。
(2)步骤Ⅱ滤渣返回再次浸取的目的是_____________________________________________。
(3)步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图1所示:

图1 图2
pH小于2.3时,铁去除率低,其原因是_______________________________________。
(4)步骤Ⅳ能说明沉淀已洗涤干净的操作是________________________________________。
(5)步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为_____________________________;沉铬时,溶液pH与铬的回收率关系如图2所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com