
| A. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| C. | 20ml 0.1mol/L CH3COONa溶液与10ml HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
分析 A.等浓度、等体积的醋酸与氢氧化钠恰好反应生成醋酸钠,根据醋酸钠溶液中的质子守恒判断;
B.氨水为弱碱,混合液中氨水过量,溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒判断;
C.反应后溶质为等浓度的醋酸钠、醋酸和氯化钠,混合液呈酸性,则c(H+)>c(OH-),结合物料守恒和电荷守恒判断;
D.反应后溶质为碳酸钠,碳酸根离子水解,溶液呈碱性,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3- ).
解答 解:A.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,恰好反应生成醋酸钠,根据质子守恒可知:c(OH-)=c(H+)+c(CH3COOH),故A错误;
B.室温下,pH=2的盐酸与pH=12的氨水等体积混合,氨水过量,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+ )>c(Cl-),溶液中离子浓度大小为:c(NH4+ )>c(Cl-)>c(OH-)>c(H+),故B错误;
C.20ml 0.1mol/L CH3COONa溶液与10ml HCl溶液混合后溶液呈酸性,反应后溶质为等浓度的醋酸钠、醋酸和氯化钠,混合液呈酸性,则c(H+)>c(OH-),说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Cl-)>c(CH3COOH),溶液中离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),故C正确;
D.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成碳酸钠,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3- ),正确的离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3- ),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒的含义及应用,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 家庭用的“84”消毒液与洁厕灵能混合使用,不会发生中毒事故 | |
| C. | 可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 | |
| D. | 硅胶可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向酸性KMnO4溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加 KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大 量共存 |
| D | 向10mL 0.1mol•L-1 Na2S溶液中滴入2mL 0.1mol•L-1 ZnSO4溶液,再加入 2mL 0.1mol•L-1 CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅具有很好的导电性,可用于制取光导纤维 | |
| C. | 盛有甲醇的试剂瓶上,应贴上 警示标签 警示标签 | |
| D. | 钙、钡、铁、铂等金属有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的结构示意图: | |
| B. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氢氧根离子的电子式: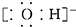 | |
| D. | NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液可除油污:CO32-+H2O?HCO3-+OH- | |
| B. | NaHCO3可作发酵粉:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | |
| C. | Na2CO3可用NaOH溶液吸收CO2制备:2OH-+CO2═CO32-+H2O | |
| D. | NaHCO3与食醋混用,产生CO2气体:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com