
【题目】(题文)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
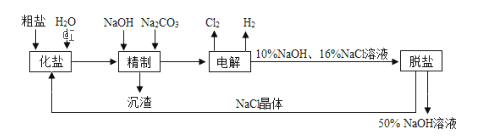
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的离子方程式是________,________.
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ ,该钡试剂可以是____
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(3)电解过程中所发生反应的化学方程式为________,与电源正极相连的电极附近产生的气体是________,检验该气体可使用的试纸及现象是.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:
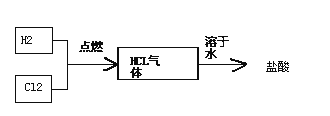
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是________.合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97%________.
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为________.
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显________色,往B试管中通入干燥的氯化氢气体,试纸显________色.最后向C试管中加入物质________(填化学式),他之所以加入这种物质的理由是________.
【答案】 CaCl2+Na2CO3=CaCO3↓+2NaCl;MgCl2+2NaOH=Mg(OH)2↓+2NaCl A,C 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ Cl2 湿润的碘化钾淀粉变蓝 先通H2点燃后再通Cl2 用100 mL刻度瓶收集满HCl气体,倒置置于水中,水升至97 mL以上即认为符合要求 Cl2+2NaOH→NaCl+NaClO+H2O 红 蓝 H2O 证明单独的氯化氢气体或水均不能使蓝色石蕊试纸变色
2NaOH+H2↑+Cl2↑ Cl2 湿润的碘化钾淀粉变蓝 先通H2点燃后再通Cl2 用100 mL刻度瓶收集满HCl气体,倒置置于水中,水升至97 mL以上即认为符合要求 Cl2+2NaOH→NaCl+NaClO+H2O 红 蓝 H2O 证明单独的氯化氢气体或水均不能使蓝色石蕊试纸变色
【解析】
(1)工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去反应为氯化钙和碳酸钠反应生成碳酸钙沉淀,氯化镁和氢氧化钠反应生成氢氧化镁沉淀,所以化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(2)除去粗盐中的SO42﹣,可加Ba2+形成BaSO4白色沉淀,因为不能引进其他阴离子,所以钡试剂只能用Ba(OH)2或BaCl2,故AC正确;
(3)在电解过程中,与电源负极相连的电极为阴极,电解池中阴极氢离子得到电子生成氢气,电极反应式为:2H++2e-=H2↑;阳极氯离子失去电子生成氯气2Cl--2e-= Cl2↑,电解过程中反应的化学方程式为: 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,氯气能够使淀粉碘化钾溶液变蓝,可用湿润的淀粉碘化钾试纸检验氯气,现象是试纸变为蓝色;
2NaOH+H2↑+Cl2↑,氯气能够使淀粉碘化钾溶液变蓝,可用湿润的淀粉碘化钾试纸检验氯气,现象是试纸变为蓝色;
(4)氯气有毒,为保证氯气完全反应,应该先通入氢气,再通入氯气,通入氯气前应先点燃氢气,氯化氢易溶于水,所以验证的方法是:取一个有刻度的玻璃瓶,收集一瓶合成气,倒放在水槽中,观察水面上升的高度,进行粗略估计,用100mL刻度瓶收集满HCl气体,置于水中,水升至97mL以上即认为符合要求;
(5)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为: Cl2+2NaOH=NaCl+NaClO+H2O;
(6)盐酸是一种酸,盐酸溶液中的氢离子能使蓝色石蕊试液变成红色,氯化氢既不属于酸也不属于碱,不能能使蓝色石蕊试纸变色,仍为蓝色;盐酸能使蓝色石蕊试纸变红,盐酸是氯化氢气体的水溶液,氯化氢气体和水能不能使蓝色石蕊试纸变红,通过B试管中实验已经排除了单独的氯化氢气体不能使蓝色石蕊试纸变色,还需要进一步排除单独的水也不能使使蓝色石蕊试纸变色,要利用控制变量法向C试管中单独加入水进行试验,水的化学式为H2O。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答。
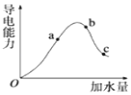
①a、b、c三点的氢离子浓度由小到大的顺序为______。
②a、b、c三点中,醋酸的电离程度最大的一点是______。
③测得某醋酸溶液中氢离子浓度为0.004molL﹣1,则醋酸的电离度为_____,该温度下醋酸的电离平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图下装置进行制取。
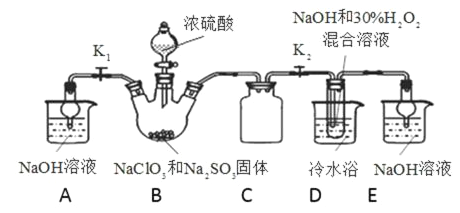
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是__________________________________。
(2)B中产生的ClO2是__________(填“氧化产物”或“还原产物”)。
(3)装置D中反应生成NaClO2的化学方程式为____________________________。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有SO42-,检验SO42-离子的方法是________________。
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度。测定时进行如下实验:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中,FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是
A. 装置F、I中的试剂依次为水,硫酸亚铁溶液
B. 装置J收集的气体中不含NO
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,溶液的颜色变化应该是( )
A. 颜色变浅 B. 逐渐变为红色
C. 没有改变 D. 变为棕黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某气体能使品红溶液褪色,则该气体是SO2
B. 等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2
Cu(NO3)2
C. 用分别蘸有浓氨水和浓盐酸的玻璃棒相互靠近会产生白烟,也可用浓硫酸代替浓盐酸
D. 把过量Cu放入少量的稀硝酸中至完全反应后,再加入稀硫酸可以产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)向CuSO4溶液中逐滴滴加氨水至过量,过程中会先有沉淀生成,后沉淀逐渐溶解。
①写出沉淀溶解过程的离子方程式___________________。
②Cu2+基态时核外电子排布式为____________________。
③金属铜采取_____堆积。
④NH3分子空间构型为__________________。
(2)制备CrO2Cl2的反应为:K2Cr2O7+3CCl4=2KC1+2CrO2Cl2+3COC12↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为____________________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相似,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO____FeO(填“>”、“<”或“=”)。
(4)Ni和La的合金是目前使用广泛的储氢材料。具有大容量、高寿命、耐低温等特点,在日本和中国己实现了产业化。该合金的晶胞结构如下图所示。

①该晶体的化学式为_______________________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是_________cm3(用含M、d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。
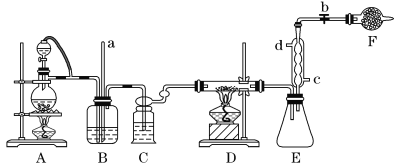
资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)检查该装置气密性的方法是_______________________________________________。
(2)实验中B装置的作用是____________________。
(3)写出D装置中物质制备的化学方程式________________________________;写出四氯化钛在空气中发烟的化学方程式______________________________。
(4)E处球形冷凝管的冷却水应从________(填“c”或“d”)口通入。
(5)F装置中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com