
| A. | 淀粉溶液中滴入碘水--变蓝色 | B. | 溴化银见光分解--变黑色 | ||
| C. | 苯酚溶液中滴入Fe 3+--变紫色 | D. | 胆矾空气中久置--变白色 |
科目:高中化学 来源: 题型:选择题
| A. | C消耗的速率与A消耗的速率相等 | |
| B. | 单位时间内生成a mol B,同时消耗a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
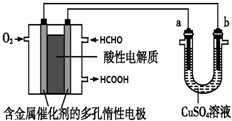
| A. | 当a、b都是铜做电极时,电解的总反应方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑ | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4 OH- | |
| C. | 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- | |
| D. | 燃料电池工作时,负极反应为:HCHO+H2O-2e-═HCOOH+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
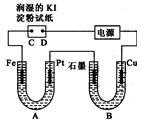 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: A,、Na2S B,、Na2CO3 C,、Na2SO4 D,、Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.1000mol•L-1碘的标准溶液,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3Na2S, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O32-+I2═S4O${\;}_{6}^{2-}$+2I- Ⅰ、判断达到滴定终点的现象是溶液由无色变蓝色,且半分钟不褪色 Ⅱ、产品纯度:(9/W)×100%. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
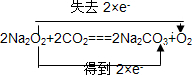 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com