
50℃和1.01×105 Pa时,该反应能自发进行:2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,其自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于能量效应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
A.丙烷与氯气在光照的作用下的反应 B.乙烯与溴的四氯化溶液的反应
C.乙烯与水的反应 D.乙烯自身生成聚乙烯的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯跟一卤代烷在催化剂作用下,可生成苯的同系物。如在催化剂作用下:
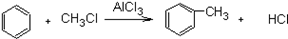 ,苯和下列各组物质合成乙苯最好应选用的是( )
,苯和下列各组物质合成乙苯最好应选用的是( )
A.CH3CH3和Cl2 B.CH2=CH2和HCl C.CH2=CH2和Cl2 D.CH3CH3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
CH3CH2CH2CH3(g)+6.5O2(g) = 4CO2(g)+5H2O(l) △H =-2878 kJ/mol
(CH3)2CHCH3(g)+6.5O2(g) = 4CO2(g)+5H2O(l) △H =-2869 kJ/mol
下列说法正确的是( )
A.正丁烷的稳定性大于异丁烷
B.异丁烷分子中的碳氢键比正丁烷的多
C.等物质的量的正丁烷能量大于异丁烷能量
D.异丁烷转化为正丁烷的过程是一个放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷在氧气中燃烧的反应为:P4 + 5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol—1、P—O b kJ·mol—1、P=O c kJ·mol—1、O=O d kJ·mol—1。
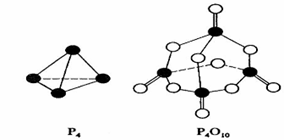
根据图示的分子结构和有关数据下列推断正确的是( )
A.6a+5d < 4c + 10b B.△H = (4c+12b-6a-5d) kJ·mol—1
C.6a+5d > 4c + 12b D.△H = (6a+5d-4c-12b) kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2mol NH3,经过一段时间后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为( )
A.25% B.20% C.10% D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应。
(1)O2的转化率为多少? (计算结果保留小数点后一位数字)
(2)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(3)平衡时体系中SO3的百分含量(体积分数)为多少?(计算结果保留小数点后一位数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度不同压强(P1<P2)下,可逆反应2X(g) 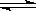 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
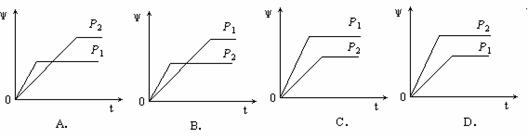
查看答案和解析>>
科目:高中化学 来源: 题型:
1)稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热。
① 实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式 ;
② 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。
则实验测得的中和热△H=____ ___(保留1位小数)
③ 如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”);理由是____________
(2)在催化剂的作用下CH4还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO。理论上每消耗标况下22.4 L NO就能放出290 kJ的热。写出该反应的热化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com