
分析 (1)在25℃时,在0.01mol/L HCl溶液中,c(H+)=c(HCl)=0.01mol/L,根据pH=-lgc(H+)计算即可,碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式计算;
(2)溶液稀释10倍,溶液中氢离子浓度变为原先的$\frac{1}{10}$,稀释100倍,氢离子浓度变为原先的$\frac{1}{100}$;溶液稀释10000倍后,酸溶液不可能变为碱溶液,溶液中c(H+)≈10-7mol/L.
解答 解:(1)在25℃时,在0.01mol/L HCl溶液中,c(H+)=c(HCl)=0.01mol/L,pH=-lgc(H+)=-lg0.01mol/L=2;0.01mol/L的NaOH溶液中氢氧根离子浓度为0.01mol/L,根据离子积常数KW=c(H+)•c(OH-),知,溶液中氢离子浓度c(H+)=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,所以溶液的pH=12,
答:0.01mol/LHClpH值是2;0.01mol/L的NaOH溶液pH值是12;
(2)常温下,在浓度为10-4mol/L的盐酸溶液中,c(H+)=10-4mol/L,将该盐酸稀释10倍后,溶液中氢离子浓度为:c(H+)=10-4mol/L×$\frac{1}{10}$=10-5mol/L,pH=-lgc(H+)=5,将上述溶液稀释100倍,计算出的氢离子浓度为:c(H+)=10-4mol/L×$\frac{1}{100}$=10-6mol/L,pH=-lgc(H+)=6,将上述溶液稀释10000倍,计算出的氢离子浓度为:c(H+)=10-4mol/L×$\frac{1}{10000}$=10-8mol/L,由于溶液中存在大量电离平衡,则此时溶液中c(H+)≈10-7mol/L,pH=-lgc(H+)≈7,
答:pH=4的盐酸用水稀释10倍、100倍、10000倍,pH值各为5、6、7.
点评 本题考查了pH的有关计算,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 石墨和金刚石一样稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1 mol C(石墨)比1 mol C(金刚石)的总能量高 | |
| D. | 1 mol C(石墨)比1 mol C(金刚石)的总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
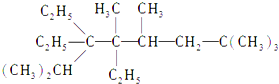 2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,
2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物:Na2O、CO、Al2O3、Na2O2 | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 氧化物:Fe2O3、NO、SO2、H2O | D. | 电解质:KNO3、Cl2、HCl、BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温时,在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | 等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的质量:Na2CO3<NaHCO3 | |
| D. | NaHCO3和Na2CO3溶液的物质的量浓度相同时,溶液的pH:Na2CO3>NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com