
【题目】不可以用于区别乙烯和乙烷气体的是( )
A.苯B.溴水C.酸性高锰酸钾溶液D.溴的四氯化碳溶液
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)→2NH3(g)+CO2(g).判断该分解反应已经达到化学平衡的是( )
A.密闭容器中混合气体的密度不变
B.密闭容器中c(NH3):c(CO2)=2:1
C.2v(NH3)=v(CO2)
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是 ( )
A.HgCl2属于离子化合物B.HgCl2属于共价化合物
C.HgCl2属于非电解质D.HgCl2中既存在离子键也存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧元素的质量在数值上等于氧气摩尔质量的是( )
A. 22.4 L氧气 B. 阿伏加德罗常数个氧原子
C. 0.032 kg氧气 D. 1 mol氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法错误的是( )。
A. 甲烷分子是由极性键构成的分子
B. 甲烷分子具有正四面体结构
C. 甲烷分子中4个C—H键完全相同
D. 甲烷分子中具有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A.0.3 mol·L1的Na2SO4溶液中含有Na+和![]() 的总物质的量为0.9 mol
的总物质的量为0.9 mol
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和![]() 的物质的量相等,则K+和Cl的物质的量浓度一定相等
的物质的量相等,则K+和Cl的物质的量浓度一定相等
D.10 ℃时,0.35 mol·L1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O(相对分子质量为250),恰好达到饱和,该溶液密度为1.21 g/cm3,求:
(1)该溶液中溶质电离出的阴、阳离子的总物质的量为________。
(2)该溶液中CuSO4的物质的量浓度为________。
(3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃、101 kPa | 22.4 |
O2 | 0 ℃、101 kPa | 22.4 |
CO | 0 ℃、101 kPa | 22.4 |
H2 | 0 ℃、202 kPa | 11.2 |
CO2 | 0 ℃、202 kPa | 11.2 |
N2 | 273 ℃、202 kPa | 22.4 |
NH3 | 273 ℃、202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①_____________________________________________;
②_____________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
(1)测定中和热.
(i)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):,
(ii)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因可能是(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
(2)酸碱中和滴定.
(i)某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.实验中不必用到的是
A.酸式滴定管 B.容量瓶 C.锥形瓶 D.铁架台
(ii)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 当时,即停止滴定.
(iii)若滴定开始和结束时,酸式滴定管中的液面如图所示:已知用c(HCl)=0.10mol/L
的盐酸标定25mL的氢氧化钠溶液,测得c(NaOH)mol/L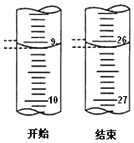
(iv)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是(填序号).
A.锥形瓶用蒸馏水洗净后没有干燥
B.碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com