
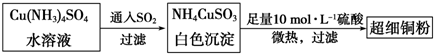
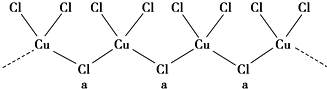
| 6 |
| 2 |
361×
| ||
| 4 |
| 1 |
| 4 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、醋酸溶液和氢氧化钠溶液的反应:H++OH-═H2O | ||||
| B、硫酸铜溶液与氢氧化钡溶液的反应:Ba2++SO42-═BaSO4↓ | ||||
| C、向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | ||||
D、用氢氧化钠溶液检验氯化铵溶液中铵根离子:NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
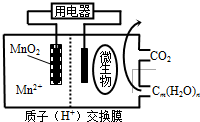
| A、分子组成为Cm(H2O)n的物质一定是糖类 |
| B、微生物所在电极区放电时发生还原反应 |
| C、放电过程中,H+从正极区移向负极区 |
| D、正极反应式为:MnO2+4H++2e-═Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
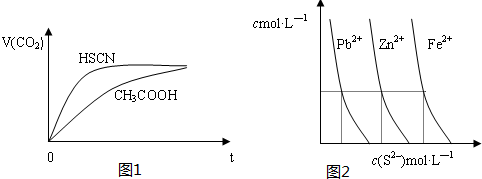
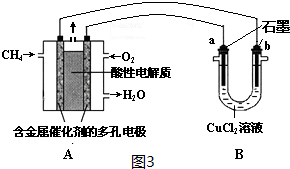
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列所示的装置中A为Zn,B为Cu,C、D均为碳棒.则
下列所示的装置中A为Zn,B为Cu,C、D均为碳棒.则查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气的大量排放影响了空气的质量,但是不会造成PM2.5值升高 |
| B、研发安全特效药物,有利于抵御人类疾病 |
| C、规范食品添加剂的生产和科学使用,有利于保障人体健康和生命安全 |
| D、推广城市生活垃圾处理的减量化、资源化和无害化技术,有利于环境保护和资源充分利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com