
| A. | NaCl固体溶于水 | B. | NH4Cl受热分解 | C. | 干冰升华 | D. | SO2气体溶于水 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 石灰水,W1=W2 | B. | 乙醇溶液,W1=W2 | C. | NaHSO4,W1<W2 | D. | CO,W1>W2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
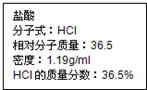 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、Ba2+、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | H+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构示意图为 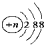 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| B. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| C. | 邻硝基甲苯的结构简式为 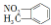 ,能发生取代反应 ,能发生取代反应 | |
| D. | 电子式分别为  和 和 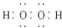 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mol•(L•min)-1 | B. | 0.1mol•(L•s)-1 | C. | 0.2mol•(L•s)-1 | D. | 0.4mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
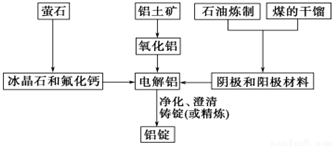
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com