
| A. | AgNO3 | B. | H2SO4 | C. | NaOH | D. | Ba(OH)2 |
分析 四种盐溶液的阳离子各不相同,可从阳离子鉴别的角度分析,鉴别阳离子,可加入碱,结合沉淀的颜色等角度判断,以此解答该题.
解答 解:A.均与硝酸银反应生成白色沉淀,不能鉴别,故A错误;
B.均与硫酸不反应,不能鉴别,故B错误;
C.加入NaOH,Na2SO4无现象,MgCl2生成白色沉淀,FeCl2生成白色沉淀迅速变成灰绿色最后总变成红褐色,Al2(SO4)3先生成白色沉淀后沉淀溶解,(NH4)2SO4生成刺激性气体,四种物质现象各不相同,可鉴别,故C正确;
D.Na2SO4、MgCl2、Al2(SO4)3均与氯化钡反应生成白色沉淀,不能鉴别,故D错误.
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L水的物质的量为1mol | |
| B. | 标准状况下,1mol任何气体所占的体积都约为22.4L/mol | |
| C. | 标准状况下,1mol氦气的质量为4g,其所占的体积约为22.4L | |
| D. | 常温常压下,1mol CO2所占的体积不可能等于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
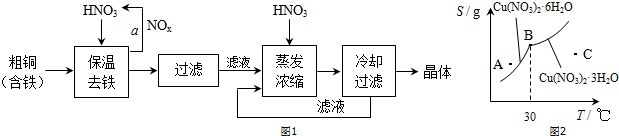
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| B. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| C. | 除去溴苯中少量的溴,可以加水后分液 | |
| D. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
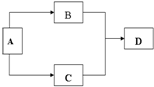 由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.
由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
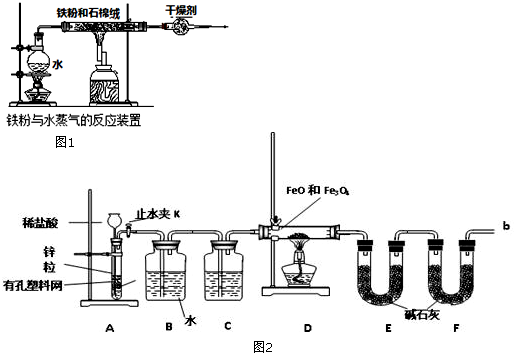
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
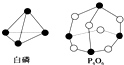 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )| A. | 放热1638 kJ | B. | 吸热1638 kJ | C. | 吸热3276 kJ | D. | 放热3276 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com