
| A. | 制成合金保护船体 | B. | 是外加电流的阴极保护法 | ||
| C. | 船体的反应:Fe-2e→Fe2+ | D. | 锌块的反应:Zn-2e→Zn2+ |
分析 在海轮的船壳上连接锌块,则船体、锌和海水构成原电池,船体做正极,锌块做负极,海水做电解质溶液,据此分析.
解答 解:在海轮的船壳上连接锌块,则船体、锌和海水构成原电池,船体做正极,锌块做负极,海水做电解质溶液.
A、在海轮的船壳上连接锌块是形成原电池来保护船体,而非合金,故A错误;
B、在海轮的船壳上连接锌块是形成原电池来保护船体,锌做负极被腐蚀,船体做正极被保护,是牺牲阳极的阴极保护法,故B错误;
C、船体做正极被保护,溶于海水的氧气放电:O2+4e-+2H2O=4OH-,故C错误;
D、锌做负极被腐蚀:Zn-2e→Zn2+,故D正确.
故选D.
点评 本题考查了金属的电化学腐蚀和防护,难度不大,应注意的是在船体上连接的锌块做负极.


科目:高中化学 来源: 题型:解答题
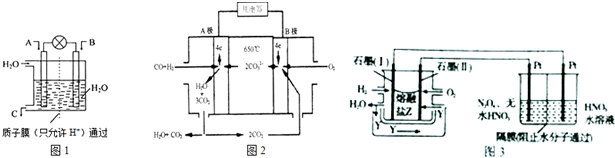
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 6.0mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢是复合材料 | B. | 铝是黑色金属材料 | ||
| C. | 石英是半导体材料 | D. | 水泥是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和AlCl3溶液反应 | B. | 最高价氧化物对应水化物的碱性 | ||
| C. | 单质与H2O反应的难易程度 | D. | 同浓度NaCl和AlCl3溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| C. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
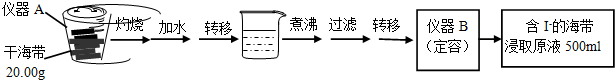
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
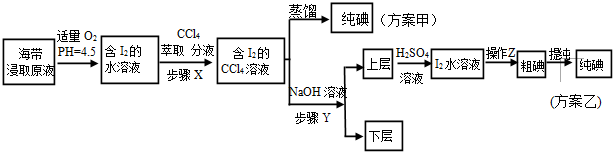
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com