
【题目】有机物D可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的D为无色黏稠液体,易溶于水,为研究D的组成与结构,进行了如下实验:
(1)称取D 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:D的相对分子质量为______。
(2)将此9.0 g D在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。则D的分子式为___________。
(3)另取D 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。实验结论:D中含有的官能团的名称是:_________、_________ 。
(4)D的核磁共振氢谱如下图:

实验结论:D的核磁共振氢谱中出现四组峰,即有不同化学环境的氢原子种数为4种,且峰面积之比为________。
(5)综上所述,D的结构简式______。
【答案】90 C3H6O3 羧基 羟基 1∶1∶1∶3 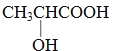
【解析】
(1)同温同压下,气体的密度之比等于相对分子质量之比,据此计算;
(2)浓硫酸增重为水的质量,碱石灰增重为二氧化碳质量,据此计算有机物、水、二氧化碳物质的量,进而计算n(H)、n(C),根据质量守恒确定是否含有O元素,根据元素守恒来确定有机物的分子式;
(3)能与足量的NaHCO3粉末反应,说明含有-COOH,根据生成的二氧化碳的物质的量确定-COOH数目,能与钠反应生成氢气,结合生成氢气的物质的量确定是否含有-OH及羟基数目;
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比;
(5)由D的分子式、含有的官能团及核磁共振氢谱书写其结构简式。
(1)由其密度是相同条件下H2的45倍,可知D的相对分子质量为:45×2=90,故答案为:90;
(2)将此9.0 g D在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g,则水为5.4 g,二氧化碳为13.2 g,由题意可推知:n(D)=![]() =0.1mol,n(C)=n(CO2)=
=0.1mol,n(C)=n(CO2)=![]() =0.3mol,n(H)=2n(H2O)=2×
=0.3mol,n(H)=2n(H2O)=2×![]() =0.6mol,则n(O)=
=0.6mol,则n(O)=![]() =0.3mol,所以D的分子式为C3H6O3,故答案为:C3H6O3;
=0.3mol,所以D的分子式为C3H6O3,故答案为:C3H6O3;
(3)0.1molD与NaHCO3反应生成2.24 L CO2(标准状况),即放出0.1molCO2,则说D中应含有一个羧基,而与足量金属钠反应生成2.24 L H2(标准状况),即生成0.1molH2,说明D中还含有一个羟基,故答案为:羧基;羟基;
(4)核磁共振氢谱中有4个吸收峰,面积之比为1∶1∶1∶3,可知A中应含有4种不同环境的氢原子,故答案为:1∶1∶1∶3;
(5)综上所述,D的分子式为C3H6O3,其分子中含有羟基和羧基,且含有4种H原子,则D的结构简式为: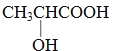 ,故答案为:
,故答案为: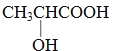 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e-+2H+=NO+H2O
C.传感器工作时H+移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
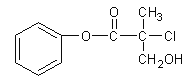
A.1mol A最多能与4mol H2发生加成反应
B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某科研小组从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲设计工艺流程如图所示。下列有关说法正确的是( )
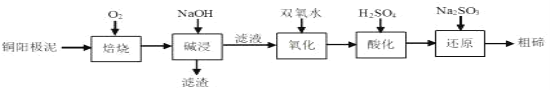
已知: ①“焙烧”后,碲主要以TeO2形式存在
②TeO2微溶于水,易溶于强酸和强碱
A.“焙烧”用到的主要硅酸盐产品仪器:蒸发皿、酒精灯、玻璃棒
B.“还原”时氧化剂与还原剂的物质的量之比为1:2
C.为加快“氧化”速率温度越高越好
D.TeO2是两性氧化物,碱浸时反应的离子方程式为TeO2 +2OH- =TeO32- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,1 L含0.1 mol HA和0.1 mol NaA的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a | 通入0.01 mol HCl | 加入0.01 mol NaOH | |
pH | 4.76 | 4.67 | 4.85 |
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法正确的是
A.溶液a和 0.1 mol·L1 HA溶液中H2O的电离程度前者小于后者
B.向溶液a中通入0.1 mol HCl时,A结合H+生成 HA,pH变化不大
C.该温度下HA的Ka=10-4.76
D.含0.1 mol·L1 Na2HPO4 与0.1 mol·L1 NaH2PO4的混合溶液也可做缓冲溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示转化关系判断下列说法正确的是( )
![]()
A.(C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体
B.可以利用与新制Cu(OH)2悬浊液反应生成砖红色沉淀证明反应①的最终产物为葡萄糖
C.酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸
D.向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 的分子结构,下列说法正确的是( )
的分子结构,下列说法正确的是( )
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 除苯环外的其余碳原子不可能都在一条直线上
C. 12个碳原子不可能都在同一平面上
D. 所有原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) + Q,下列叙述正确的是
2Z(g)+W(s) + Q,下列叙述正确的是
A.加入少量W,υ(逆)增大B.压强不变时,反应达到平衡状态
C.升高温度,υ(逆)、υ(正)都增大D.平衡后加入X,方程式中的Q增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(![]() )的别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,有芳香气味,用于配制香水、香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
)的别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,有芳香气味,用于配制香水、香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
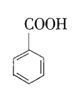 +CH3CH2OH
+CH3CH2OH![]()
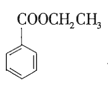 +H2O
+H2O
已知:苯甲酸在100℃会迅速升华。相关有机物的性质如表所示。
名称 | 相对分子质量 | 颜色及状态 | 沸点/℃ | 密度/( |
苯甲酸 | 122 | 无色鳞片状或针状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.7 | 0.78 |
实验步骤如下:
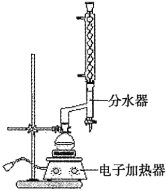
①在圆底烧瓶中加入![]() 苯甲酸,
苯甲酸,![]() 乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装置装好仪器,控制温度在65~70℃加热回流2h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装置装好仪器,控制温度在65~70℃加热回流2h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中的液体后,关闭旋塞继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入![]() 至溶液呈中性。用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加人氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
至溶液呈中性。用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加人氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为![]() 。
。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是________(填序号)。
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中使用分水器不断分离除去水的目的是______________。
(3)步骤②中应控制加热蒸馏的温度为________(填序号)。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入![]() 的作用是________________________________;若
的作用是________________________________;若![]() 的加入量不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是__________________。
的加入量不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是__________________。
(5)关于步骤③中的萃取分液操作的叙述正确是________(填序号)。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算可得本实验的产率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com