
����Ŀ�����⻯��(NaBH4)��Ӧ�ù㷺�����ܽϺõĻ�ԭ���������ᡢ�״����⻯��(NaH)Ϊԭ�Ͽ��Ƶ����⻯�ơ�ijѧϰС���ͬѧ��������ͼ��ʾ·����ʵ���Һϳ����⻯�ơ�

I.�⻯�Ƶ��Ʊ�
��֪NaH�Ļ�ѧ��Ӧ���Ժܸߣ��ڳ�ʪ�Ŀ���������ȼ������Ӵ����ų�������������ȼ��������ը����С���ͬѧ������ͼ�е�װ����ʵ������ȡNaH��

(1)NaH����Ԫ�صĻ��ϼ�Ϊ___________��NaH�ĵ���ʽΪ___________��
(2)�������������Ӹ������ӿڣ�˳��Ϊa��___________b��c(��ӿ���ĸ)������װ�ú����ʵ�飬�ڸ�װ��B����ǰ��������е�һ��������___________��
(3)װ��A��ʢװϡ�������������Ϊ___________��װ��D��Ӧʢװ���Լ���___________��
(4)����������ʵ��װ����һ�����ԵIJ�����____________������˲���Ĵ�ʩ��__________��
��.���⻯�Ƶ��Ʊ��봿�Ȳⶨ
�ڽ�����ȵ�220��ʱ����ʢװNaH�����Ϸ�Ӧ���м�������������[B(OCH3)3]�����µ�260�棬��ַ�Ӧ���������õ�NaBH4�ͼ״��ơ�
(5)ijͬѧ��ͨ���ⶨ���⻯����ˮ��Ӧ����������������ⶨ���⻯�Ʋ�Ʒ�Ĵ��ȡ�
��֪��NaH+H2O=H2��+NaOH��
�����⻯����ˮ��Ӧ���Բ�������������ƫ�����ƣ��÷�Ӧ����ʽΪ___________��
�ڸ�ͬѧ��ͼװ�òⶨ���⻯�Ʋ�Ʒ�Ĵ���(����ֻ���⻯��)��װ����a��������_________����ȡ6.28g�⻯����Ʒ���ظ�ʵ��������Σ�������������ƽ�����Ϊ13.44L(������Ϊ��״��)������Ʒ�����⻯�ƵĴ���Ϊ___________%(���������λ��Ч����)��

���𰸡�-1 ![]() g��f��d��e ����H2�Ĵ��� ��Һ©�� ��Һ δ��ֹ�����е�ˮ��������װ��B�� ��װ��B֮������һ������װ�� NaBH4+2H2O=NaBO2+4H2�� ƽ����ѹ������Һ��˳������ 85
g��f��d��e ����H2�Ĵ��� ��Һ©�� ��Һ δ��ֹ�����е�ˮ��������װ��B�� ��װ��B֮������һ������װ�� NaBH4+2H2O=NaBO2+4H2�� ƽ����ѹ������Һ��˳������ 85
��������
(1)����Na�Ļ��ϼ�Ϊ+1�ۣ�������������Ԫ���������ϼ۴����͵���0�����������γ����ӻ����ÿ�����ﵽ�ȶ��ṹ��
(2)��Aװ������ȡH2��ͨ��Dװ�ó�ȥH2�е�HCl���ʣ���ͨ��Cװ�ø�����ͨ��Bװ����ȡNaH�����ӡ������װ�õĵ����ܶ��dz����̳�������H2�ǿ�ȼ�����壬�ڼ�����ȡNaHǰ������Ҫ����H2���ȣ�Ȼ���ټ��ȣ�
(3)����װ��ͼ��A�Ľṹ�ж�ʢװϡ�������������Ϊ��װ��D�������dz�ȥ�����е�HCl���ʣ��ɸ���HCl�����ʣ�ȷ������Ӧʢװ���Լ���
(4)����NaH�ڳ�ʪ�Ŀ���������ȼ,���װ��ͼ�и���װ�õ����ÿ�֪ȱ��һ������װ�ã�ȱ��ʲô�ͼ�ʱ����ʲôװ�ã�
(5)�ٸ�����֪���ʺʹ������ʽ�������غ㶨����д����ʽ��
�ڵ���a����ͨ�������ã����������ӵ�λ�á���������÷�����
��ȡ6.28g�⻯����Ʒ�������ķ�Ӧ������NaBH4+2H2O=NaBO2+4H2����Na+H2O=NaOH+H2�����ɷų�����������������������ʵ��������ݹ����������H2�����ʵ������ɼ�������⻯�Ƶ����������ɵ��䴿�ȡ�
(1)��NaH��Na�Ļ��ϼ�Ϊ+1�ۣ������ڻ�����������Ԫ���������ϼ۴����͵���0������HΪ-1�ۣ�NaHΪ���ӻ����Naʧȥ���������γ�Na+��Hԭ�ӻ��1�������γ�H-������ͨ�����Ӽ���ϣ�����ʽΪ![]() ��
��
(2)��Aװ������ϡ������Zn��Ӧ��ȡH2������������лӷ��ԣ���ȡ��H2�к���HCl��H2O��Ȼ��ͨ��Dװ�ó�ȥHCl���壬��ͨ��Cװ�õ�Ũ�����H2���и�������ܶ��dz����̳�����ʱ�͵õ����������H2������ͨ��Bװ�ã�����װ���ڵĿ��������ų�������Ϊ����������ʱ����װ��B���ȣ�������Ӧ��2Na+H2![]() 2NaH�����������������Ӹ������ӿڣ�˳��Ϊa��g��f��d��e��b��c���ڸ�װ��B����ǰ��������е�һ�������Ǽ����c�ų���H2�Ĵ��ȣ�
2NaH�����������������Ӹ������ӿڣ�˳��Ϊa��g��f��d��e��b��c���ڸ�װ��B����ǰ��������е�һ�������Ǽ����c�ų���H2�Ĵ��ȣ�
(3)����װ��ͼ��������A�Ƿ�Һ©����װ��DĿ���dz�ȥH2�е�HCl���ʣ��ɸ���HCl��ˮ��Һ�����ԣ��ü������ʵ�ˮ��Һ��NaOH��Һ�����ճ�ȥHCl���ʣ�
(4) NaH�ڳ�ʪ�Ŀ���������ȼ,����(2)�ķ�������ȡװ�ø������ֵ����ã���֪��ȱ��һ����ֹ�����е�ˮ��������װ��B��װ�ã�����˲���Ĵ�ʩ����װ��B֮������һ������װ�ã�
(5)���������⻯����ˮ��Ӧ���Բ�������������ƫ�����ƣ���÷�Ӧ����ʽΪNaBH4+2H2O=NaBO2+4H2����
�ڵ���a����ͨ�������ã�ʹҺ����������ѹǿһ�£�����©���е�Һ�������������¿���˳�����¡����װ����a��������ƽ����ѹ������Һ��˳�����£�
6.28g�⻯����Ʒ��������Ӧ��NaBH4+2H2O=NaBO2+4H2����NaH+H2O=NaOH+H2�����ų����������ʵ���Ϊn(H2)= 13.44L��22.4L/mol=0.6mol������NaBH4�����ʵ���Ϊx��NaH�����ʵ���Ϊy����38x+24y=6.28g��4x+y=0.6�����x=0.14mol��y=0.04mol������Ʒ�����⻯�ƵĴ���Ϊ![]() =85%��
=85%��


 �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ᾧˮ�������ʽΪRnH2O������Է�������ΪM��25��ʱ��a g��������b gˮ�м����ͣ��γ�V ml�ܶ�Ϊ�� g/cm3����Һ�����в���ȷ���� �� ��
A. ������Һ����������Ϊ![]() B. 25��,R���ܽ��Ϊ
B. 25��,R���ܽ��Ϊ![]() g
g
C. ������Һ����������Ϊ![]() D. ������Һ���ʵ���Ũ��Ϊ
D. ������Һ���ʵ���Ũ��Ϊ![]() mol/L
mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���ش��й�����:

��1�����л�ѧ��������õ�Ԫ�أ���ԭ�ӽṹʾ��ͼΪ______��
��2��Ԫ�آ�����ԭ�Ӱ뾶��С��ϵ�ǣ���______��(�������������
��3���ܢ���Ԫ����Ƚϣ������Խ�ǿ����______ (��Ԫ�����ƣ���
��4��Ԫ�آٵ�����������ˮ����Ļ�ѧʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ˮ���й�����ȷ����: ( )
A. AlCl3��Һ��NaAlO2��Һ���ȡ�������Ũ�����ᾧ�����գ����ù���ijɷ���ͬ
B. ����FeCl3��Һʱ����FeCl3�����ܽ��������У�Ȼ������ˮϡ�͵������Ũ��
C. �ü��ȵķ����ɳ�ȥKCl��Һ�л��е�Fe3��
D. ʳ�����ܽ�ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
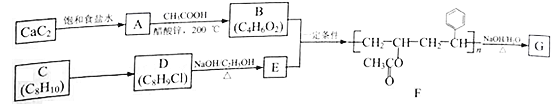
����Ŀ���߷��ӻ�����G�ǿɱ�ϸ����Ϊ̼Դ����Դ���õľۺ������һ������ɽ���߷��Ӳ��ϣ���ʳƷ��ҩƷ��װ������ж������ơ���֪A~G��Ϊ�л����������Ϊ�߷��ӻ�����G��һ�ֺϳ�·�ߣ�
�ش��������⣺
(1)��CaC2�Ʊ�A�Ļ�ѧ����ʽΪ_________________________________��
(2)A����B�ķ�Ӧ����Ϊ______________________��
(3)C�Ļ�ѧ������___________��C��D�����Լ��������ֱ���___________��___________��
(4)E�Ľṹ��ʽΪ______________________��
(5)�����廯����H��D��ͬ���칹�壬��H���ܵĽṹ����___________��(������D)��д���˴Ź���������������ҷ����֮��Ϊ1�U2�U6��H��ͬ���칹��Ľṹ��ʽ___________(��дһ��)��
(6)��F����G�Ļ�ѧ����ʽΪ_________________________________��
(7)�ο�������Ϣ�������1��2��������ͱ�����Ϊԭ����ȡ![]() �ĺϳ���·ͼ(���Լ���ѡ)__________________��
�ĺϳ���·ͼ(���Լ���ѡ)__________________��
��֪����OH��̼̼˫�����˵�̼ԭ��ֱ���������ȶ������Ա����CHO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����373Kʱ����0.5mol N2O4����ͨ�����Ϊ5L�ĺ����ܱ�������,�������ֺ���ɫ����Ӧ���е�2��ʱ,NO2��Ũ��Ϊ0.02 mol/L����60��ʱ,��ϵ�Ѵ�ƽ��,��ʱ������ѹǿΪ��ʼʱ��1.6��������˵����ȷ���ǣ� ��
A. ǰ2�룬��N2O4��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol/(L��s)
B. ��2��ʱ��ϵ�ڵ�ѹǿΪ��ʼʱ��1.2��
C. ��ƽ��ʱ��ϵ�ں�N2O40.20mol
D. ƽ��ʱ������ٳ���һ����N2O4, ������N2O4��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը���ұ���̻�(��Ҫ�ɷ�Ϊͭп���Ȼ������������Σ�������Ԫ�غ���Ԫ��)Ϊԭ�ϣ��ɻ����Ʊ�Cu��ZnSO4��H2O������Ҫʵ���������£�

��֪����Fe3����ȫ����pHΪ3.2����ʱZn2����Cu2��δ��ʼ��������K3[Fe(CN)6]�����ڼ���Fe2����3Fe2����2[Fe(CN)6]3��===Fe3[Fe(CN)6]2��(����ɫ)������Ԫ�ؽ���ˮ���жԻ�����Ⱦ��ͨ����������ȥ��
(1)�������Ⱦ�����85 �������½��У����˵ļ��ȷ�ʽΪ________��
(2)��ϴ����ʱ����Һ��Cu2����Ҫת��ΪCu(OH)2��Cu2(OH)2CO3��Ҳ�ᷢ������Ӧ�õ�Cu2(OH)3Cl�������ų����壬�ø���Ӧ�����ӷ���ʽΪ________________________������NaOH��Һ���м�ϴ����ʱ��Ũ�Ȳ��˹���ͨ���±������ݷ�����ԭ����___________��
NaOH��ҺŨ�ȶ������ʺ�����Ԫ�ؽ����ʵ�Ӱ��

(3)ZnSO4���ܽ����������ͼ��ʾ������⡱����Һ�л���ZnSO4��H2O��ʵ�顢����Ϊ___________��

(4)��Һ1����Һ2�к�һ������Cu2����Zn2����Ϊ���ԭ�������ʣ��ɲ�ȡ�Ĵ�ʩ�У�����Һ1����Һ2��ϣ�����ͭп�����ѭ��ʹ�õ����̲�����________(�ѧʽ)��
(5)��֪H3AsO3�Ļ�ԭ��ǿ��Fe2����Ksp(FeAsO3)>Ksp(FeAsO4)��5.7��10��21��������Һ��������Ԫ��(��Fe2������)����Ԫ��(��H3AsO3����)��Ũ�ȷֱ�Ϊ1.15 g��L��1��0.58 g��L��1���ɲ��á������к�����������ȥ�������ʵ�鷽���� ____________________________(ʵ������ʹ�õ��Լ��У�30%˫��ˮ��0.001 mol��L��1K3[Fe(CN)6]��Һ�����յ�ͭп������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����8.12�����۱�ը����һ�������軯��й¶���軯�����������ˮ���о綾�������ˮ��Ⱦ��Ϊ�����Ӷ��軯����˽⣬ͬѧ�Dz������Ͻ���ѧϰ��̽����
̽���軯������ʣ���֪��������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
25������ƽ�ⳣ�� | Ki=1.77��10��4 | Ki=5.0��10��10 | Ki1=4.3��10��7 Ki2=5.6��10��11 |
��1��NaCN��Һ�ʼ��Ե�ԭ����________________________���������ӷ���ʽ��ʾ��
��2����ͼ��ʾ�����£�ϡ��HCOOH��HCN�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ����_________

A����ͬŨ�ȵ�HCOONa��NaCN�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��Na+����c��CN������c��HCOO������c��OH������c��H+��
B����NaCN��Һ��ͨ������������̼�����ӷ���ʽΪ��CN��+CO2+H2O=HCN+CO32��
C��ͼ����a�������Ũ��С��b�������Ũ��
D��c����Һ�ĵ����Ա�a����Һ�ĵ�������
��3��H2O2������ɫ�������������ƣ�Ҳ������ˮ�е��軯���KCN���������·�Ӧʵ�֣�KCN+H2O2+H2O�TA+NH3������������A�Ļ�ѧʽΪ_____��
��4�������������ӽ��H+����������ǿ����______________________________________��
A. HCOO- B. CN- C. CO32- D.HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���й����ʵ���Ũ�ȹ�ϵ��ȷ����(����)
A. 0.1 mol/L��NaHA��Һ����pH��4��c(HA��)��c(H��)��c(H2A)��c(A2��)
B. NaHCO3��Һ�У�c(H��)��c(H2CO3)��c(OH��)
C. �����£���pH��1��CH3COOH��Һ��pH��13��NaOH��Һ�������ϣ���Һ������Ũ�ȴ�С��˳��Ϊ��c(Na��)��c(CH3COO��)��c(OH��)��c(H��)
D. �����£���pH��8��NaA��Һ�У�c(Na��)��c(A��)��9.9��10��7 mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com